题目内容
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
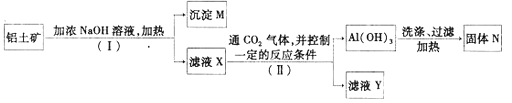
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
【答案】 过滤 Fe2O3 2Al(OH)3![]() Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 硅酸钠(或Na2SiO3)
Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 硅酸钠(或Na2SiO3)
【解析】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝,向铝土矿中加入浓NaOH溶液并加热,Al2O3、SiO2都和NaOH反应生成可溶性的钠盐,Fe2O3不和NaOH反应,然后过滤得到的沉淀M为Fe2O3,滤液X中含有Na2SiO3、NaAlO2,通入CO2并控制一定条件过滤得到Al(OH)3,滤液Y中含有碳酸钠和硅酸钠,将Al(OH)3洗涤过滤加热,Al(OH)3分解生成Al2O3和水,则N为Al2O3;则
(1)I和II步骤中分离溶液和沉淀的操作是过滤。(2)沉淀M中除含有泥沙外,一定还含有难溶于NaOH溶液的氧化物,Fe2O3不和NaOH反应,然后过滤得到的沉淀M为Fe2O3,生成固体N反应的化学方程式为2Al(OH)3![]() Al2O3+3H2O。(3)根据以上分析可知滤液X中含铝元素的溶质的化学式为NaAlO2,它属于盐类物质。(4)氢氧化铝是两性氢氧化物,能溶于强碱溶液中,实验室里常往AlCl3溶液中加入氨水来制取Al(OH)3,该反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。(5)根据以上分析可知滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有硅酸钠或Na2SiO3。
Al2O3+3H2O。(3)根据以上分析可知滤液X中含铝元素的溶质的化学式为NaAlO2,它属于盐类物质。(4)氢氧化铝是两性氢氧化物,能溶于强碱溶液中,实验室里常往AlCl3溶液中加入氨水来制取Al(OH)3,该反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。(5)根据以上分析可知滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有硅酸钠或Na2SiO3。

【题目】实验室常用的分离操作有:①萃取分液法②结晶法③分液法④蒸馏法⑤过滤法。选择以上方法分离混合物,选择正确的是( )
A. | 饱和食盐水与沙子的混合物 | ①萃取分液法 |
B. | 水和汽油的混合物 | ④蒸馏法 |
C. | 从碘的水溶液里提取碘 | ③分液法 |
D. | 从硝酸钾和氯化钠的混合液中获得硝酸钾 | ②结晶法 |
A.A B.B C.C D.D