题目内容
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)制备铁红(Fe2O3)的生产流程如下:
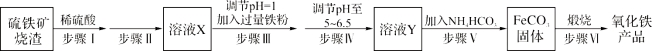
试回答下列问题:
(1)步骤Ⅰ所得溶液中铁元素的化合价是 。
(2)实验室中实现步骤Ⅱ中分离操作需要的仪器有 、铁架台、玻璃棒、烧杯。
(3)步骤Ⅲ中发生的离子方程式 ,向反应后的溶液中加入试剂 ,当观察到 说明步骤Ⅲ已经进行完全。
(4)步骤Ⅳ中不能选用试剂 调节溶液的pH(填字母编号)。
a.FeO固体 b.氢氧化钠溶液 c.Fe2O3固体 d.氨水
(5)室温下FeCO3达到溶解平衡时溶液pH=8.5,c(Fe2+)=1.2×10-6 mol·L-1。则FeCO3固体产物中 (选填“有”或“无”)Fe(OH)2。(已知:Ksp[Fe(OH)2]=4.8×10-16)
(6)步骤Ⅵ中发生反应的化学反应方程式为 。
【答案】(1)+2、+3(1分);(2)漏斗(1分);
(3)2H++Fe=Fe2++H2↑,2Fe3++Fe=3Fe2+;KSCN溶液;无血红色现象;
(4)bc;(5)无;(6)4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
【解析】
试题分析:(1)根据四氧化三铁、氧化亚铁和氧化铁可知步骤Ⅰ所得溶液中铁元素的化合价是+2和+3价。
(2)实验室中步骤Ⅱ是过滤,分离操作需要的仪器有漏斗、铁架台、玻璃棒、烧杯。
(3)步骤Ⅲ是将铁离子还原成亚铁离子,又因为溶液中还存在氢离子,则步骤Ⅲ中发生的离子方程式为2H++Fe=Fe2++H2↑、2Fe3++Fe=3Fe2+;检验步骤Ⅲ已经进行完全,即溶液中没有铁离子,可以用KSCN溶液;即向反应后的溶液中加入试剂KSCN溶液,当观察到无血红色现象说明步骤Ⅲ已经进行完全。
(4)步骤Ⅳ中调节pH值的试剂要能与酸反应且不引入新的杂质,所以用氧化亚铁或氨水较好,答案选bc。
(5)由题中数据可知,溶液中c(Fe2+)c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=4.9×10-17,故无Fe(OH)2沉淀生成;
(6)步骤Ⅵ中发生反应为碳酸亚铁在空气中与氧气发生氧化还原反应,可生成氧化铁,反应的化学反应方程式为4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。

【题目】以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如下图所示。
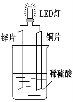
某实验兴趣小组做完实验后,在读书卡片上记录如下:

(1)在卡片上,记录合理的是(填序号)。
(2)其他条件相同情况下,产生气泡的速率比单一锌片(填“快”或“慢”),如果将锌片换成铁片,电路中的电流方向(填“变”或“不变”)。
(3)如果把硫酸换成硫酸铜溶液,猜测(填“锌片”或“铜片”)变厚,原因是(用电极方程式表示)。实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为mol。
(4)有同学利用原电池原理,将A、B、C、D四种金属设计成下表中装置进行实验用以判断四种金属的活泼性强弱。
序号 | 甲 | 乙 | 丙 |
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据以上现象,判断四种金属活泼性由强到弱的顺序是。
【题目】在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)![]() 2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )
2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )

X | Y | |
A | 减小压强 | A的转化率 |
B | 升高温度 | 混合气体平均分子量 |
C | 升高温度 | A的浓度 |
D | 增加压强 | B的转化率 |