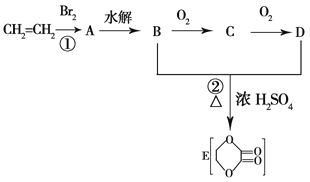
题目内容
【题目】某科研小组以难溶性钾长石(K2OAl2O36SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
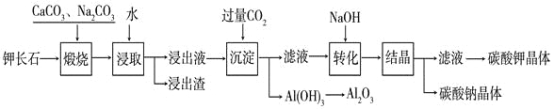
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是:______________________________。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O![]() Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是______________________________(用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______________、_______________和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是___________________。长时间电解后,需要更换新的石墨电极的是________极(填“阴”或“阳”)。
【答案】Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ 碱 HCO3-+ OH-=H2O + CO32- Na2CO3 CO2 Al3++ 3e-=Al 阳
2NaAlO2+CO2↑ 碱 HCO3-+ OH-=H2O + CO32- Na2CO3 CO2 Al3++ 3e-=Al 阳
【解析】
钾长石(K2OAl2O36SiO2)加入碳酸钠和碳酸钙煅烧,煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,氧化铝和碳酸钠发生的反应为:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑,氧化铝和碳酸钙发生类似的反应,都生成二氧化碳。用水浸取,进入水溶液中,然后通入过量的二氧化碳,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤液中含有碳酸氢钾、碳酸氢钠,加入氢氧化钠溶液,生成碳酸钠和碳酸钾。
2NaAlO2+CO2↑,氧化铝和碳酸钙发生类似的反应,都生成二氧化碳。用水浸取,进入水溶液中,然后通入过量的二氧化碳,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤液中含有碳酸氢钾、碳酸氢钠,加入氢氧化钠溶液,生成碳酸钠和碳酸钾。
(1)根据原子守恒可知,氧化铝和碳酸钠在高温下反应生成偏铝酸钠的同时,一定还有二氧化碳产生,所以反应化学方程式为Na2CO3+Al2O3![]() 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(2)偏铝酸根离子水解呈碱性,所以要抑制其水解,“浸取”时应在碱性条件下进行。
(3)由工艺流程可知,滤液中主要含有碳酸氢钾、碳酸氢钠,“转化”时加入NaOH,将碳酸氢钾、碳酸氢钠转化为碳酸钾、碳酸钠,反应离子反应方程式为HCO3-+ OH-=H2O + CO32-。
(4)煅烧时需要碳酸钠,在流程图提取碳酸钾之前可得到碳酸钠,所以碳酸钠是可以参与可循环利用的物质。在浸出液中需通二氧化碳,而碳酸钙与二氧化硅、氧化铝和碳酸钠在高温下反应都有二氧化碳生成,所以二氧化碳也是可以参与循环使用的物质。
(5)电解池中连接电源负极的电极为阴极,阴极得到电子,发生还原反应。所以铝离子在阴极放电生成Al,电极反应式为Al3++ 3e-=Al。电极过程中阳极生成氧气,生成的氧气会和碳反应生成二氧化碳,阳极石墨被消耗,因此需要更换新的石墨电极的是阳极。

【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
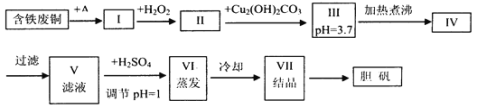
pH值控制可参考下列数据
物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用__(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的__。
(3)Ⅱ中加Cu2(OH)2CO3的目的是__,其优点是__。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为__。
(5)V中加H2SO4调节pH=1是为了__。