题目内容
【题目】I、根据如图回答下列问题。
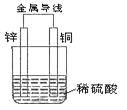
(1)该原电池外电路中电流方向:锌_______铜(填“→”或“←”)。
(2)该原电池中_______电极(写出电极材料名称)产生无色气泡, 写出该电极反应式:_______;该电极发生 _______反应(填“氧化”或“还原”)。 当电路中通过 0.2mol 电子时,该电极上产生的气体在标准状况下的体积为_____L。
(3)一段时间后,烧杯中溶液的 pH______(填“增大”或“减小”)。
II、美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示:两个 电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
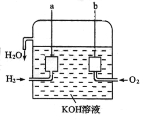
(1)a 极是_____,电极反应式是_____。
(2)b 极是_____,电极反应式是_____。
【答案】← 铜 2H++2e-=H2↑ 还原 2.24L 增大 负极 2H2-4e-+4OH-=4H2O 正极 O2+4e-+2H2O=4OH-
【解析】
I、锌、铜和稀硫酸形成的原电池,锌易失电子作负极,铜作正极,负极上锌发生氧化反应Zn-2e-═Zn2+,正极上氢离子得电子发生还原反应2H++2e-=H2↑,据此分析解答;
II、氢氢氧燃料电池的总反应为2H2+O2=2H2O,通入氢气的一极a为电源的负极,通入氧气的一极为原电池的正极,结合电解质溶液的性质分析解答。
I、(1)锌、铜和稀硫酸形成的原电池,锌易失电子作负极,铜作正极,外电路中电流从正极流向负极,即该原电池外电路中电流方向:锌←铜,故答案为:←;
(2)锌、铜和稀硫酸形成的原电池,锌易失电子作负极,铜作正极,负极上锌发生氧化反应Zn-2e-═Zn2+,正极上氢离子得电子发生还原反应2H++2e-=H2↑,正极上产生氢气,发生还原反应,当电路中通过0.2mol电子时,该电极上产生的气体在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故答案为:铜;2H++2e-=H2↑;还原;2.24L;
(3)正极的反应式为:2H++2e-═H2↑,负极上的反应Zn-2e-═Zn2+,反应中消耗了氢离子,溶液的酸性减弱,pH增大,故答案为:增大。
II、(1)氢氧燃料电池中,通入氢气的一极为原电池的负极,通入氧气的一极为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2-4e-+4OH-=4H2O,故答案为:负;2H2-4e-+4OH-=4H2O;
(2)氢氧燃料电池中,通入氧气的一极为原电池的正极,正极的电极反应式为:O2+4e-+2H2O=4OH-,故答案为:正;O2+4e-+2H2O=4OH-。

【题目】I.草酸与高锰酸钾在酸性条件下能够发生如反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,用 4mL 0.001mol/L KMnO4 溶液与2mL 0.01mol/L H2C2O4 溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2mL | 20 | |
Ⅱ | 2mL | 20 | 10 滴饱和 MnSO4 溶液 |
Ⅲ | 2mL | 30 | |
Ⅳ | 1mL | 20 | 1mL 蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为_____
(2)如果研究催化剂对化学反应速率的影响,使用实验_________和_____(用Ⅰ~Ⅳ表示,下同); 如果研究温度对化学反应速率的影响,使用实验_____和_________.
(3)对比实验Ⅰ和Ⅳ,可以研究_____对化学反应速率的影响,实验Ⅳ中加入 1mL蒸馏水的目的是_______
II、利用如图装置采用适当试剂可完成某探究实验,并得出相应实验结论.请根据相关信息回答:

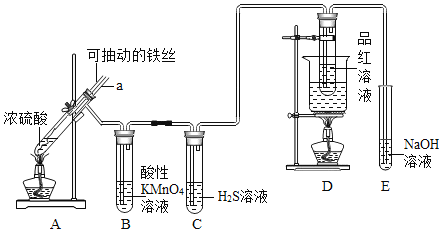
(1)为了证明元素的非金属性强弱是 S>C>Si.你认为各物质应该是: 甲为______;乙为______;丙为______.(已知乙中有气泡产生,丙中 有白色沉淀)
(2)如果甲为水,乙为 Na2O2 粉末,丙为 H2S 的饱和水溶液.实验中观察到丙中生成淡黄色沉淀。说明元素O、S得电子能力强弱为 ______。
(3)将该装置连接好后,在加入药品开始实验前还需进行气密性检查,请你简述该操作_____。
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。