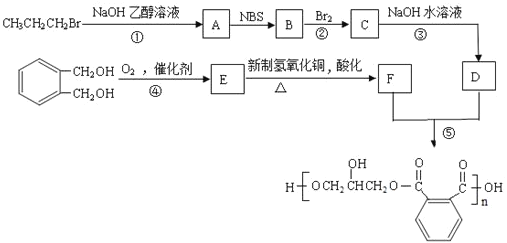
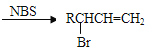
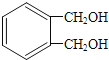
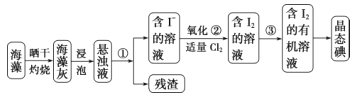
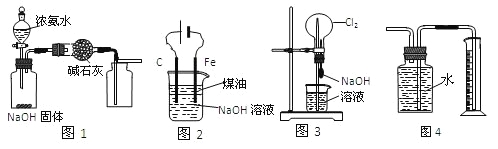
题目内容
【题目】若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
【答案】C
【解析】
在阴离子中,阴离子的核外电子数=质子数+电荷数,质量数=质子数+中子数。
R元素原子的质量数为A,则w g Rm-的物质的量为n(Rm-)=![]() mol。Rm-离子有x个电子,电荷数为m,由于阴离子的核外电子数=质子数+电荷数,所以Rm-离子核内质子数=核外电子数-电荷数=x-m;根据质量数=质子数+中子数,可得Rm-原子核内的中子数=质量数-质子数=A-(x-m)=A-x+m,所以w g Rm-离子中含有中子的物质的量为
mol。Rm-离子有x个电子,电荷数为m,由于阴离子的核外电子数=质子数+电荷数,所以Rm-离子核内质子数=核外电子数-电荷数=x-m;根据质量数=质子数+中子数,可得Rm-原子核内的中子数=质量数-质子数=A-(x-m)=A-x+m,所以w g Rm-离子中含有中子的物质的量为![]() mol×(A-x+m)=
mol×(A-x+m)=![]() (A-x+m) mol,故合理选项是C。
(A-x+m) mol,故合理选项是C。

 名校课堂系列答案
名校课堂系列答案【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。