题目内容
【题目】α氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为![]() +Cl2(g)
+Cl2(g)![]() +HCl(g) ΔH
+HCl(g) ΔH
在T1℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯(g)和0.40 mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是 ( )
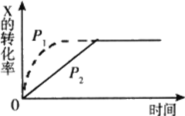
A.T1℃时,反应在0~2min内的平均速率v(α-氯乙基苯)=0.05mol·L-1·s-1
B.10min后,若保持其他条件不变,升高温度至T2℃,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH>0
C.温度从T1℃升至T2℃时,正向反应速率增大,逆向反应速率减小
D.T1℃时,体系的总压不变时,反应达到平衡状态
【答案】B
【解析】
A.由数据图表可知,反应在0~2min内,HCl的物质的量增加了0.20mol,根据反应原理方程式,α-氯乙基苯作为生成物,在反应中生成了0.20mol,即△n=0.2mol,容器体积为V=2L,反应所经历的时间为△t=2min,则反应在0~2min内的平均速率v(α-氯乙基苯)=![]() ,故A错误;
,故A错误;
B.平衡时,HCl的物质的量为0.32mol,根据反应方程式,平衡时,α-氯乙基苯的浓度应为![]() ,10min后升高温度,反应达到新平衡时α-氯乙基苯的浓度为c′=0.18mol/L,因此升高温度,化学平衡右移,表明正反应是吸热反应,吸热反应的焓变△H>0,故B正确;
,10min后升高温度,反应达到新平衡时α-氯乙基苯的浓度为c′=0.18mol/L,因此升高温度,化学平衡右移,表明正反应是吸热反应,吸热反应的焓变△H>0,故B正确;
C.温度从T1℃升至T2℃时,升温会使反应速率都增大,正向反应速率增大,逆向反应速率也增大,故C错误;
D.反应 ![]() +Cl2(g)
+Cl2(g)![]() +HCl(g)前后气体体积相等,体系的总压一直保持不变,因此T1℃时,体系的总压不变时,不能判断是否达到平衡状态,故D错误;
+HCl(g)前后气体体积相等,体系的总压一直保持不变,因此T1℃时,体系的总压不变时,不能判断是否达到平衡状态,故D错误;
答案选B。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案