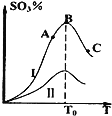
题目内容
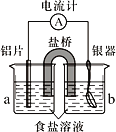
【题目】用如图所示装置进行如下实验,能达到实验目的的是( )
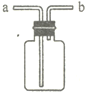
A.瓶中盛满水,从b口进气,用排水法收集NO2
B.瓶中盛适量浓硫酸,从a口进气干燥NH3
C.从b口进气,用排空气法收集CO2
D.瓶中装满水,a口连接导管并伸入量筒中,从b口进气,测量生成H2的体积
【答案】D
【解析】
A. 二氧化氮易与水反应生成硝酸和一氧化氮,故不能用排水法。只能用向上排空气法,A项错误;
B. 氨气与浓硫酸反应,不能用浓硫酸干燥氨气,B项错误;
C. 二氧化碳密度大于空气的密度,应用向上排空气法,对此图应该从长导管(a)进,短导管(b)出,C项错误;
D. 测量氢气体积,瓶内装满水,因为氢气的密度小于水的密度,氢气应从短导管进,长导管接量筒,D项正确;
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】TK时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率小于60%