题目内容
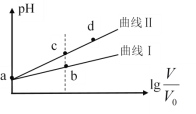
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是
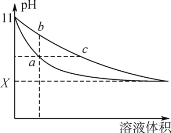
A. b点溶液导电能力比a点溶液强
B. 对于b、c两点,电离平衡常数Kb>Kc
C. 与盐酸完全反应时,消耗盐酸体积:Va>Vc
D. X的值接近7,但大于7
【答案】AD
【解析】
根据信息可知氢氧化钠溶液和氨水具有相同的体积和pH,由于氢氧化钠是强电解质,一水合氨是弱电解质,则氢氧化钠的浓度小于氨水,稀释过程中,促进一水合氨电离,所以pH变化大的是氢氧化钠,变化小的是氨水,据此分析作答。
根据上述分析可知:
A.溶液的导电能力与离子浓度成正比, b点的离子浓度大于a点的,所以b点溶液导电能力比a点溶液强,A项正确;
B.电离平衡常数只与温度有关,温度不变,一水合氨的电离平衡常数不变,B项错误;
C.等pH的氨水和氢氧化钠,氨水的浓度大于氢氧化钠,等体积的二者,氨水的物质的量大于氢氧化钠,碱的物质的量越大消耗同浓度酸的体积越多,即Va<Vc,C项错误;
D.碱无限稀释时,溶液的pH接近于7,但仍然大于7,不能等于7或小于7,D项正确;
答案选AD。

【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。