题目内容
【题目】碳在冶金工业上具有重要用途。已知氧与碳的反应主要有:
Ⅰ.C(s)+O2(g)CO2(g) △H1=-394kJ·mol-1
Ⅱ.2C(s)+O2(g)2CO(g) △H2=-221kJ·mol-1
Ⅲ.2CO(g)+O2(g)2CO2(g) △H3
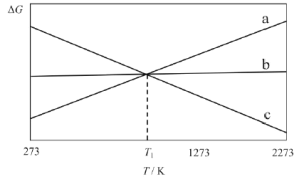
上述反应的△G~T如图所示,且满足△G=△H-T△S。
请回答:
(1)曲线a代表反应_________(填“I”、“II”或“III”),理由是__________。
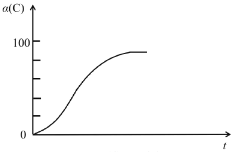
(2)研究发现,以CO2替代高温水蒸气作为煤气化反应(H2O与C反应)的气化剂,实现了CO2零排放的新工艺。写出反应IV的热化学方程式___________(碳的计量数为1)。在1273K时,测得碳转化率[α(C)]与时间t变化如图所示。保持其它条件不变,请画出1773K时α(C)~t关系图______。
(3)当T=T1时,反应IV处于平衡状态,下列关于反应IV的说法正确的是_________。
A.因平衡时△G=0,若△H变化173.3kJ·mol-1,△S变化173.3J·K-1·mol-1,计算得T1=1000K
B.T<T1时,反应向逆反应方向移动
C.当碳的浓度不再变化时,一定处于平衡状态
D.因平衡常数K的值不再变化,反应达到了平衡
(4)当T=1273K时,仅存在CO、CO2两种气体,且维持总压为1 atm,此时反应IV的Kp=112,则CO气体所占的分压p(CO)为___________atm。(列式即可)
【答案】Ⅲ H3=-567kJ/mol,S<0,由G=H-TS,曲线斜率为正值 C(s)+CO2(g)=2CO(g) H4=+173kJ/mol 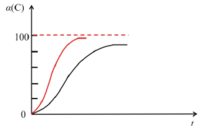 AB
AB ![]()
【解析】
(1)曲线a是上升的,曲线斜率为正值,只有H<0,S<0符合。
(2)温度升高,缩短了达到平衡的时间,反应正向进行,转化率增加。
(3)根据△G=H-TS=0解答。
(4)由于体系中只存在2种气体,设CO的分压为x,则CO2的分压为1-x,Kp=![]() ,解得x的值即可。
,解得x的值即可。
(1)上述三个反应中,只有反应ⅢH3<0,S<0,由G=H-TS,曲线斜率为正值,故本题答案为:Ⅲ;H3=-567 kJ/mol,S<0,由G=H-TS,曲线斜率为正值。
(2)以CO2替代高温水蒸气作为煤气化反应的气化剂,根据盖斯定律可知方程式为:C(s)+CO2(g)=2CO(g),H4=H2-H1=+173 kJ/mol。在1773K时,温度升高,缩短了达到平衡的时间,反应正向进行,转化率增加,所以图像为: ,故本题答案为:C(s)+CO2(g)=2CO(g) H4=+173kJ/mol;
,故本题答案为:C(s)+CO2(g)=2CO(g) H4=+173kJ/mol; 。
。
(3)A.因平衡时△G=H-TS=0,当△H变化173.3kJ·mol-1,△S变化173.3J·K-1·mol-1时, T1=![]() =1000K,A正确;
=1000K,A正确;
B.该反应为吸热反应,温度降低,逆向进行,B正确;
C.碳是纯固体,浓度看做1,不能作为化学平衡的判断依据,C错误;
D.当温度不变,改变浓度或压强,化学平衡可能发生移动,但平衡常数K的值不再变化,D错误;
本题答案为:AB。
(4)当T=1273K时,仅存在CO、CO2两种气体,且维持总压为1 atm,设CO的分压为x,则CO2的分压为1-x,Kp=![]() ,解得x=
,解得x=![]() ,故本题答案为:
,故本题答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:
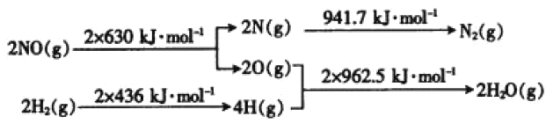
则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4min时,v(正)__v(逆) (填“>”“<”或“=”)。0~4min,H2的平均反应速率v(H2)=_mol·L-1·min-1。
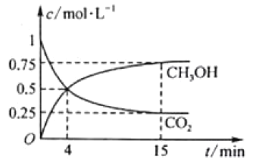
②CO2平衡时的体积分数为___,该温度下Kp为__(用含有p0的式子表示)。
③下列能说明该反应已达到平衡状态的是___。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol ·L-1 | C1 | C2 |
则乙容器中反应起始向___方向进行;c1___c2。(填“>”“<”或“=”)
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为___。
【题目】外循环三相反应器连续制备高锰酸钾新技术是目前高锰酸钾工业发展的主要方向。该法以软锰矿(主要成分为MnO2)为原料生产高锰酸钾。该工艺路线制备高锰酸钾如下:

![]()
已知:一些化合物溶解度(单位:g)随温度的变化如表
温度℃ | KMnO4 | KCl | K2CO3 |
20 | 6.4 | 34.0 | 52.5 |
90 | 45.2 | 56.7 | 60.9 |
回答下列问题:
(1)原料软锰矿与氢氧化钾按一定的比例在“进料”时加热熔融后再和氧气进行“反应”,“进料”前应将软锰矿粉碎,其作用是____。
(2)“反应”中发生反应的化学方程式为____。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即向溶液中通入CO2气体,使体系呈中性或弱碱性。
K2MnO4发生歧化反应时,能否用盐酸代替CO2____(请填写“能”或“不能”)。待锰酸钾全部歧化后,静置一段时间后过滤。从滤液中得到高锰酸钾晶体的操作是:____。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为____,电解产物____可以循环利用。
③“CO2歧化法”和“电解法”相比较,K2MnO4的理论利用率之比为____。
【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。