题目内容
【题目】(1)比较金属性的强弱:Na_________K(填“>”、“<”或“=”);反应Na+KClNaCl+K↑能发生的原因是________________。
(2)COCl2是共价化合物,各原子均满足8电子稳定结构。写出COCl2的结构式__________。
(3)电解熔融氧化铝制备金属铝时,需要定期更换阳极石墨块,理由是_________________(用化学反应方程式表示)。
【答案】< 该反应为熵增反应 ![]() C+O2
C+O2![]() CO2
CO2
【解析】
(1)金属性的强弱:同主族从上往下依次增强,同周期从左往右依次减弱;
(2)COCl2是共价化合物,各原子均满足8电子稳定结构,可根据C、O、Cl形成共价键的特点写成其结构式;
(3)电解熔融氧化铝制备金属铝时,阳极石墨会和氧气反应,被消耗。
(1) 金属性的强弱:同主族从上往下依次增强,同周期从左往右依次减弱,所以Na的金属性小于K的金属性;反应Na+KClNaCl+K↑能发生,利用钾和钠的沸点的差异,当温度达到钾的沸点之后,单质钾成为蒸汽,熵增加,同时生成物的减少促使反应不断向着正向进行,本题答案为:<;该反应为熵增反应;
(2)COCl2是共价化合物,各原子均满足8电子稳定结构。结构式为![]() ,本题答案为:
,本题答案为:![]() ;
;
(3)电解熔融氧化铝制备金属铝时,阳极石墨会和氧气反应,被消耗,发生的化学方程式是C+O2![]() CO2,本题答案为:C+O2
CO2,本题答案为:C+O2![]() CO2。
CO2。

 考前必练系列答案
考前必练系列答案【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:
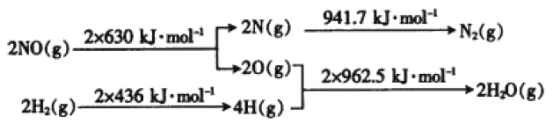
则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4min时,v(正)__v(逆) (填“>”“<”或“=”)。0~4min,H2的平均反应速率v(H2)=_mol·L-1·min-1。
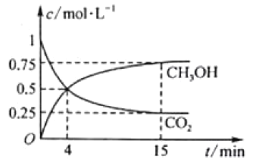
②CO2平衡时的体积分数为___,该温度下Kp为__(用含有p0的式子表示)。
③下列能说明该反应已达到平衡状态的是___。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol ·L-1 | C1 | C2 |
则乙容器中反应起始向___方向进行;c1___c2。(填“>”“<”或“=”)
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为___。


