题目内容
【题目】下面是合成药物格列卫的中间体J的一种合成路线:
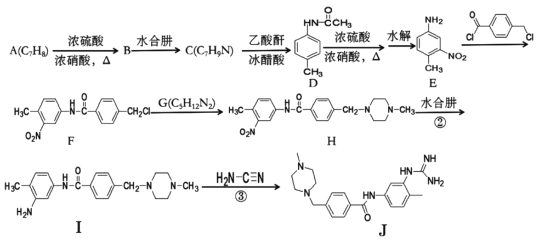
回答下列问题:
(1)A的名称为____,B的化学式为____。
(2)F中含氧官能团名称为____
(3)B→C和I→J的反应类型分别为____、____。
(4)G的结构简式为____。
(5)芳香化合物X是D的同分异构体,苯环上具有三个取代基且氨基与苯环直接相连,X能发生银镜反应,分子结构只有一个乙基,符合条件的X的结构式有____种。
(6)写出用甲苯、乙醇为原料制备对氨基苯甲酸乙酯的合成路线:_________。
【答案】甲苯 C7H7NO2 硝基、肽键(酰胺基) 还原反应 加成反应 ![]() 10
10 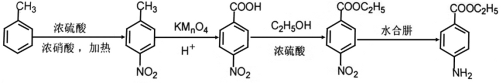
【解析】
依据D的结构简式以及A的分子式,A的结构简式为![]() ,A与浓硝酸在浓硫酸以及所给的条件下发生硝化反应反应生成B,B的结构简式
,A与浓硝酸在浓硫酸以及所给的条件下发生硝化反应反应生成B,B的结构简式![]() ,B分子中的硝基被还原为氨基,C的结构简式为
,B分子中的硝基被还原为氨基,C的结构简式为![]() ,C在乙酸酐、冰醋酸的作用下发生取代反应生成D(
,C在乙酸酐、冰醋酸的作用下发生取代反应生成D(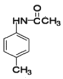 ),
), 与浓硝酸发生硝化反应生成
与浓硝酸发生硝化反应生成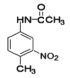 ,
, 水解生成
水解生成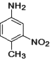 ,依据合成路线图,结合反应物、生成物的结构简式,以及反应条件,判断反应类型。
,依据合成路线图,结合反应物、生成物的结构简式,以及反应条件,判断反应类型。
(1)由分析可知,A的结构简式为![]() ,A的名称为甲苯;A与浓硝酸在浓硫酸以及题所给的条件下发生取代反应生成B,B的结构简式
,A的名称为甲苯;A与浓硝酸在浓硫酸以及题所给的条件下发生取代反应生成B,B的结构简式![]() ,B的化学式为C7H7NO2;
,B的化学式为C7H7NO2;
(2)从F结构简式可以看出,F中含有的官能团为氯原子、硝基、肽键(酰胺基);
(3)B的结构简式![]() ,B与水合肼反应生成C,B中的硝基被还原为硝基,C的结构简式为
,B与水合肼反应生成C,B中的硝基被还原为硝基,C的结构简式为![]() ,故B→C的反应类型为还原反应;根据I、H2C-C≡N、J的结构简式,I与H2N-C≡N的反应生成J的反应为加成反应;
,故B→C的反应类型为还原反应;根据I、H2C-C≡N、J的结构简式,I与H2N-C≡N的反应生成J的反应为加成反应;
(4)结合F的结构简式、G的分子式、H的结构简式,F与G发生取代反应生成H,故G的结构简式为![]() ;
;
(5)芳香化合物X是D的同分异构体,则X分子中含有苯环,苯环上具有三个取代基且氨基与苯环直接相连,X能发生银镜反应,分子结构只有一个乙基,则三个取代基分别为
![]() 、
、![]() 、
、![]() ,当
,当![]() 、
、![]() 在苯环位于邻位时,即
在苯环位于邻位时,即![]() ,则
,则![]() 在苯环上有四种位置;当
在苯环上有四种位置;当![]() 、
、![]() 在苯环上位于间位时,即
在苯环上位于间位时,即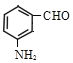 ,
,![]() 在苯环上有四种位置;当
在苯环上有四种位置;当![]() 、
、![]() 在苯环上位于对位时,即
在苯环上位于对位时,即![]() ,
,![]() 在苯环上有两种位置,故符合条件的X的结构式有10种;
在苯环上有两种位置,故符合条件的X的结构式有10种;
(6)甲苯与浓硝酸在浓硫酸以及加入的条件下发生硝化反应生成![]() ,
,![]() 发生氧化反应生成
发生氧化反应生成![]() ,
,![]() 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成 ,
, 在水合肼作用下发生还原反应生成
在水合肼作用下发生还原反应生成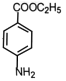 ,合成路线流程图为:
,合成路线流程图为: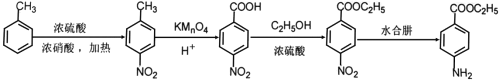 。
。

【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:
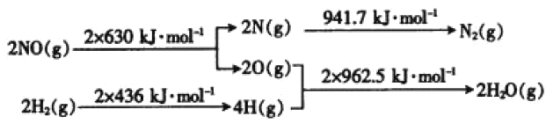
则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4min时,v(正)__v(逆) (填“>”“<”或“=”)。0~4min,H2的平均反应速率v(H2)=_mol·L-1·min-1。
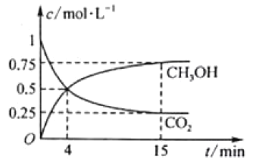
②CO2平衡时的体积分数为___,该温度下Kp为__(用含有p0的式子表示)。
③下列能说明该反应已达到平衡状态的是___。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol ·L-1 | C1 | C2 |
则乙容器中反应起始向___方向进行;c1___c2。(填“>”“<”或“=”)
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为___。
【题目】外循环三相反应器连续制备高锰酸钾新技术是目前高锰酸钾工业发展的主要方向。该法以软锰矿(主要成分为MnO2)为原料生产高锰酸钾。该工艺路线制备高锰酸钾如下:

![]()
已知:一些化合物溶解度(单位:g)随温度的变化如表
温度℃ | KMnO4 | KCl | K2CO3 |
20 | 6.4 | 34.0 | 52.5 |
90 | 45.2 | 56.7 | 60.9 |
回答下列问题:
(1)原料软锰矿与氢氧化钾按一定的比例在“进料”时加热熔融后再和氧气进行“反应”,“进料”前应将软锰矿粉碎,其作用是____。
(2)“反应”中发生反应的化学方程式为____。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即向溶液中通入CO2气体,使体系呈中性或弱碱性。
K2MnO4发生歧化反应时,能否用盐酸代替CO2____(请填写“能”或“不能”)。待锰酸钾全部歧化后,静置一段时间后过滤。从滤液中得到高锰酸钾晶体的操作是:____。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为____,电解产物____可以循环利用。
③“CO2歧化法”和“电解法”相比较,K2MnO4的理论利用率之比为____。