题目内容
20.己知浓硝酸和乙胺反应:CH3CH2NH2+HNO3=CH3CH2NH3.NO3,产物 CH3CH2NH3•NO3的熔点为12℃,在室温下能够融化电离出CH3CH2NH3+和NO3-离子,称为室温离子.下列有关正确的是( )| A. | 浓硝酸和乙胺反应属于加成反应 | |
| B. | 室溫离子可以使熔盐燃料电池在常溫下工作 | |
| C. | CH3CH2NO3中,只有σ键没有π键 | |
| D. | 融化CH3CH2•NO3晶体需要破坏分子间作用力 |
分析 A.该反应生成离子化合物,所以应该是化合反应;
B.产物 CH3CH2NH3•NO3的熔点为12℃,在室温下能电离出阴阳离子;
C.CH3CH2NH3.NO3中的NO3中含有π键;
D.熔融状态下,电离出阴阳离子的化合物属于离子化合物,离子化合物熔融状态下破坏离子键.
解答 解:A.该反应生成离子化合物而不是共价化合物,且不存在不饱和键中的化学键断裂结合原子或原子团,所以应该是化合反应而不是加成反应,故A错误;
B.产物 CH3CH2NH3•NO3的熔点为12℃,在室温下能电离出阴阳离子,所以室溫离子可以使熔盐燃料电池在常溫下工作,故B正确;
C.CH3CH2NH3.NO3中的NO3中含有π键,故C错误;
D.熔融状态下,电离出阴阳离子的化合物属于离子化合物,离子化合物熔融状态下破坏离子键而不是分子间作用力,故D错误;
故选B.
点评 本题考查物质结构和性质及化学键、微粒间作用力等知识点,综合性较强,明确该反应产物特点是解本题关键,易错选项是A,注意化合反应和加成反应的区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.U、V、W、X为四种短周期元素,有关这四种元素的说法中一定正确的是( )
| 元素 | U | V | W | X |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | V的氢化物与X的氢化物反应的产物只含有共价键 | |
| B. | 1molX的单质参加氧化还原反应时转移的电子数为1.204×1024 | |
| C. | U与W形成UW2时各原子均满足8电子稳定结构 | |
| D. | 0.3molCu分别与足量HVO3和H2WO4的稀溶液反应均产生0.2mol气体 |
11.下列说法正确的是( )
| A. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| B. | SO2具有氧化性,因此可用于漂白纸浆 | |
| C. | 植物油和裂化汽油都能使溴水褪色 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
8.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,1mol甲基(14C1H3-)所含的中子数和电子数分别为8NA、10NA | |
| B. | 标准状况下,11.2L五氯化磷中含有P-Cl键的数目为2.5NA | |
| C. | 标准状况下,2.24L Cl2全部被NaOH溶液吸收,转移的电子数目为0.2NA | |
| D. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数目为6NA |
1.“三酸二碱”在化工生产中有着重要的应用.下列说法正确的是( )
| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
| B. | 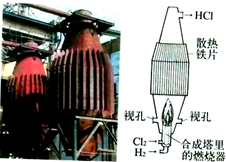 如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
8.家蝇的雌性信息素可用芥酸(来自菜籽油)与羧酸X在浓NaOH溶液中进行阳极氧化得到.电解总反应式为:C21H41COOH+X+4NaOH→C23H46+2Na2CO3+2H2O+H2↑
芥酸 雌性信息素
则下列说法不正确的是( )
芥酸 雌性信息素
则下列说法不正确的是( )
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
5.下列说法不正确的是( )
| A. | 生物质能的利用主要有以下几种方式:直接燃烧、生物化学转换和热化学转换 | |
| B. | 在人类研究物质微观结构的过程中,光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了使用 | |
| C. | 能源可分为一次能源和二次能源,化学电源也可分为一次电池和二次电池 | |
| D. | 碰撞理论和过渡态理论是常用的反应速率理论,其中过渡态理论可解释温度、催化剂等对反应速率的影响 |
6.下列对原电池的分析不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| D. | 由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |