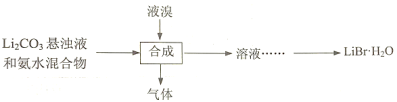
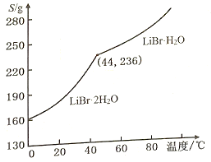
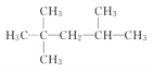
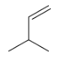
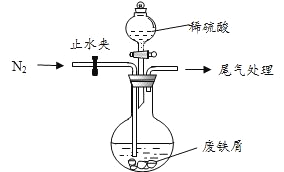
题目内容
【题目】已知在温度T1和T2时水的电离平衡曲线如图所示,下列说法错误的是
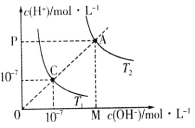
A.图中矩形OMAP的面积可以表示T2时水的离子积的值
B.水的离子积常数关系为:C > A
C.升高温度可实现由C点到A点
D.T1时,pH=4的硫酸与pH=l0的氢氧化钠溶液等体积混合,所得溶液的pH=7
【答案】B
【解析】
A. 图中矩形OMAP的面积=c(OH-)×c(H+)=KW,即表示T2时水的离子积的值,A项正确;
B. 温度升高,促进水的电离,A点c(OH-)和c(H+)均大于C点,因此水的离子积常数关系为:A > C,B项错误;
C. 升高温度,促进水的电离,c(OH-)和c(H+)均增大,能实现由C点到A点,C项正确;
D. T1时,c(OH-)×c(H+)=10-7×10-7=10-14,pH=4的硫酸溶液中c(H+)=10-4mol/L, pH=l0的氢氧化钠溶液中c(OH-)=10-4mol/L,等体积反应可得n(H+)=n(OH-),溶液呈中性,pH=7,D项正确;
答案选B。

【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10-2;Ka2=6.2×10-8 |
(1) 25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,三种溶液的pH由大到小的顺序为 _______________
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的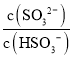 =___________
=___________
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:
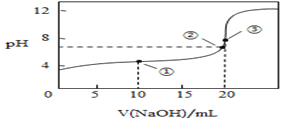
①在滴定的实验过程中,不需要的仪器或用品是________(填序号)
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:___________________________
③下列操作会导致测定结果偏高的是 _________________
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)__________c(CH3COOH)+c(H+)(填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______/span>mol/L,此时溶液中c(CrO42-)等于_________mol/L(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是___(填编号),该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
(2)实验中用左手控制___,眼睛注视___,直至滴定终点。判断滴定终点的现象是:锥形瓶中溶液___。
(3)如图是某次滴定时的滴定管中的液面,其读数为___mL。
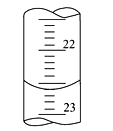
(4)根据下列数据:请计算待测盐酸溶液的浓度为___mol/L。
滴定次数 | 待测液体积(mL) | 标准液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.42 | 20.40 |
第二次 | 20.00 | 2.28 | 22.30 |
第三次 | 20.00 | 0.20 | 22.60 |