题目内容
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10-2;Ka2=6.2×10-8 |
(1) 25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,三种溶液的pH由大到小的顺序为 _______________
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的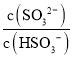 =___________
=___________
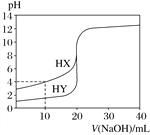
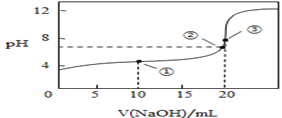
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:
①在滴定的实验过程中,不需要的仪器或用品是________(填序号)
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:___________________________
③下列操作会导致测定结果偏高的是 _________________
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)__________c(CH3COOH)+c(H+)(填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______/span>mol/L,此时溶液中c(CrO42-)等于_________mol/L(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
【答案】Na2CO3>Na2SO3>CH3COONa 0.62 ![]() 当滴入最后一滴标准液时,溶液由无色变为浅红色,且半分钟不褪色 AD
当滴入最后一滴标准液时,溶液由无色变为浅红色,且半分钟不褪色 AD ![]()
![]() c(Na+)>c(CH3COO-)> c(OH-)>c(H+) 2.0×10-5 5.0×10-3
c(Na+)>c(CH3COO-)> c(OH-)>c(H+) 2.0×10-5 5.0×10-3
【解析】
(1)酸的电离平衡常数越大,其对应的酸根离子水解程度越小,等浓度的钠盐溶液的pH越小;
(2)根据H2SO3的电离平衡常数Ka2,结合溶液中c(H+)=c(OH-)=10-7mol/L计算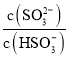 ;
;
(3)①根据酸碱中和滴定使用的仪器分析判断;
②用碱滴定酸,使用酚酞为指示剂,根据指示剂与溶液pH关系判断滴定现象;
③根据c(待测)= 分析滴定误差;
分析滴定误差;
④点①所示溶液中,为等量的醋酸和醋酸钠溶液;点②所示溶液中,NaOH的体积小于20mL,为醋酸和醋酸钠溶液;点③所示溶液,恰好反应生成醋酸钠;
(4)根据溶度积常数计算溶液中c(CrO42-)的大小。
![]() 根据题目中所给平衡常数,可知酸性:CH3COOH>HSO3->HCO3-,所以水解程度:CH3COO-<SO32-<CO32-,因此等浓度的Na2CO3溶液、Na2SO3溶液、CH3COONa溶液pH由大到小的顺序为:Na2CO3>Na2SO3>CH3COONa;
根据题目中所给平衡常数,可知酸性:CH3COOH>HSO3->HCO3-,所以水解程度:CH3COO-<SO32-<CO32-,因此等浓度的Na2CO3溶液、Na2SO3溶液、CH3COONa溶液pH由大到小的顺序为:Na2CO3>Na2SO3>CH3COONa;
(2)根据H2SO3的Ka2=6.2×10-8可知, =6.2×10-8,当c(OH-)=降至10-7mol/L时,c(H+)=c(OH-)=10-7mol/L,溶液中的
=6.2×10-8,当c(OH-)=降至10-7mol/L时,c(H+)=c(OH-)=10-7mol/L,溶液中的 =0.62;
=0.62;
(3)①在整个滴定实验过程中,需要用到的主要仪器为滴定管、锥形瓶、滴定管夹、铁架台,不需要的仪器为100mL容量瓶、漏斗和玻璃棒,合理选项是ade;
②氢氧化钠与醋酸恰好反应时生成醋酸钠,醋酸钠水解使溶液呈碱性,要以酚酞为指示剂时,开始时溶液显无色,当恰好到达滴定终点的现象为:当滴入最后一滴NaOH标准液时,溶液由无色变为浅红色,且半分钟不褪色;
③A.碱式滴定管在装液前未用标准NaOH溶液润洗,将会导致标准液的浓度偏小,消耗标准液的体积偏大,导致实验结果偏高,A正确;
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出,将会使消耗标准液的体积偏小,最终导致实验结果偏小,B错误;
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡,将会导致消耗标准液的体积偏小,使实验结果偏小,C错误;
D.达到滴定终点时,仰视读数将会导致消耗标准液的体积偏大,使实验结果偏高,D正确;
故合理选项是AD;
④点①时溶液中的溶质为醋酸和醋酸钠,物质的量关系为1:1,电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),物料守恒为2c(Na+)=c(CH3COO-)+c(CH3COOH),则c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)。由于醋酸电离作用大于醋酸钠的水解作用,溶液呈酸性,c(H+)>c(OH-),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+);
点②所示溶液中,NaOH的体积小于20mL,为醋酸和醋酸钠溶液,根据物料守恒可知c(Na+)<c(CH3COO-)+c(CH3COOH);
点③所示溶液中为醋酸钠溶液,CH3COO-发生水解反应,消耗水电离产生的H+,最终达到平衡时溶液中c(H+)<c(OH-),溶液呈碱性,c(Na+)>c(CH3COO-),盐电离产生的离子浓度大于水电离产生的离子浓度,所以所有离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)> c(OH-)>c(H+);
(4)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10![]() mol/L=2.0×10-5mol/L,则此时溶液中c(Cr
mol/L=2.0×10-5mol/L,则此时溶液中c(Cr![]() )=
)= =5.0×10-3mol/L。
=5.0×10-3mol/L。

 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案