题目内容
17.下列气体所含有原子数最多的是( )| A. | 7.5gC2H6 | B. | 14gN2 | C. | 7gCO | D. | 24gO2 |
分析 根据n=$\frac{m}{M}$计算分子的物质的量,再根据分子组成计算原子的物质的量,物质的量越大,原子数越多.
解答 解:A、7.5gC2H6的物质的量为$\frac{7.5g}{30g/mol}$=0.25mol,每个C2H6分子含有8个原子,含有原子的物质的量为0.25mol×8=2mol;
B、14gN2的物质的量为$\frac{14g}{28g/mol}$=0.5mol,氮气是双原子分子,含有原子的物质的量为1mol;
C、7gCO的物质的量为$\frac{7g}{28g/mol}$=0.25mol,是双原子分子,含有原子的物质的量为0.5mol;
D、24gO2的物质的量为$\frac{24g}{32g/mol}$=0.75mol,氧气是双原子分子,含有原子的物质的量为1.5mol.
所以7.5gC2H6含有的原子最多.
故选A.
点评 本题考查物质的量的计算,根据N=nNA=$\frac{m}{M}$NA结合分子的构成计算原子个数并比较其多少即可,难度不大.

练习册系列答案
相关题目
13.下列有关表述中正确的是( )
| A. | ${\;}_{55}^{\;}$Br的电子排布式可简写为[Ar]4s24p5 | |
| B. | 16O与18O互为同位素,H216O、H218O互为同素异形体 | |
| C. | CH4、NH${\;}_{4}^{+}$粒子的空间构型均为正四面体形 | |
| D. | NH4Cl的电子式为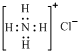 |
5.关于硅及其化合物的叙述中,错误的是( )
| A. | 硅是良好的半导体材料高温 | |
| B. | 二氧化硅能与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 光纤通信的光导纤维是由硅晶体经特殊工艺制成的 |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 18g重水含有10NA个电子 | |
| B. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数约为3NA | |
| C. | 常温下0.05mol•L-1Fe2(SO4 ) 3溶液中含Fe 3+数目小于0.1NA | |
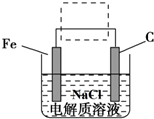
| D. | 用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体 |
2.下列有关化学用语表示正确的是( )
| A. | 用电子式表示HCl的形成过程: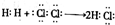 | |
| B. | Mg2+的结构示意图: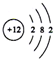 | |
| C. | HClO的结构式:H-Cl-O | |
| D. | 质量数为133,中子数为78的铯原子:${\;}_{55}^{133}$Cs |
9.常温下有①Na2CO3、②NaHCO3两种溶液,下列有关说法正确的是( )
| A. | 常温下①溶液显碱性,其主要原因为:CO32-+H2O=HCO3-+OH- | |
| B. | 可用澄清石灰水来鉴别①和②两种无色溶液 | |
| C. | 泡沫灭火器中用硫酸铝溶液和②混合快速产生CO2的反应原理为:Al3++3HCO3-=Al(OH)3↓+3CO2↑ | |
| D. | 无论①和②以何种比例、何种浓度混合,都一定有:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
7.下列说法不正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 常温常压下,32gO2含有的O原子数为NA | |
| C. | 1mol甲烷的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4L 甲烷和乙炔的混合气体所含的分子数为NA |
 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑