题目内容
9.常温下有①Na2CO3、②NaHCO3两种溶液,下列有关说法正确的是( )| A. | 常温下①溶液显碱性,其主要原因为:CO32-+H2O=HCO3-+OH- | |
| B. | 可用澄清石灰水来鉴别①和②两种无色溶液 | |
| C. | 泡沫灭火器中用硫酸铝溶液和②混合快速产生CO2的反应原理为:Al3++3HCO3-=Al(OH)3↓+3CO2↑ | |
| D. | 无论①和②以何种比例、何种浓度混合,都一定有:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
分析 A.水解为可逆的微弱的;
B.加入澄清的石灰水,Na2CO3溶液和NaHCO3溶液都能生成沉淀;
C.泡沫灭火器中用硫酸铝溶液和②混合快速产生CO2的反应原理为铝离子与碳酸氢根发生双水解反应;
D.根据电荷守恒判断.
解答 解:A.水解为可逆的微弱的,所以①溶液显碱性,其主要原因为:CO32-+H2O?HCO3-+OH-,故A错误;
B.加入澄清的石灰水,Na2CO3溶液和NaHCO3溶液都能生成CaCO3沉淀,不能区别两种溶液,故B错误;
C.泡沫灭火器中用硫酸铝溶液和②混合快速产生CO2的反应原理为铝离子与碳酸氢根发生双水解反应,反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故C正确;
D.无论①和②以何种比例、何种浓度混合,根据电荷守恒都一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D错误.
故选C.
点评 本题考查Na2CO3和NaHCO3的性质,题目难度不大,本题侧重于二者水解的考查,易错点为B,注意与澄清石灰水反应的性质.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
6.不用其他试剂,能将下列各溶液加以鉴别的是( )
| A. | Na2CO3溶液和稀盐酸 | B. | NaHCO3溶液和稀盐酸 | ||
| C. | AlCl3溶液和NH3•H20溶液 | D. | 澄清石灰水和NaHCO3溶液 |
17.下列气体所含有原子数最多的是( )
| A. | 7.5gC2H6 | B. | 14gN2 | C. | 7gCO | D. | 24gO2 |
14.下列离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2C1O-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ | |
| C. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+═2Fe3++2H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
1.根据键能与键长数据,推断下列分子的稳定顺序,正确的是( )
| 物质 | N2 | Cl2 | Br2 | I2 | O2 |
| 键能 (kJ•mol-1) | 945 | 243 | 193 | 151 | 498 |
| 键长(nm) | 0.110 | 0.199 | 0.228 | 0.266 | 0.121 |
| A. | N2>Cl2>Br2>O2>I2 | B. | O2>N2>I2>Br2>Cl2 | ||
| C. | I2>Br2>Cl2>O2>N2 | D. | N2>O2>Cl2>Br2>I2 |
18.下列离子方程式书写正确的是( )
| A. | 金属钠加入水中:Na+H2O=Na++OH-+H2↑ | |
| B. | 碳酸氢钙溶液跟氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| C. | 氢氧化钡溶液滴入硫酸氢钠溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | 亚硫酸钠和足量的稀硝酸混合:SO32-+2H+=SO2↑+H2O |
 最难
最难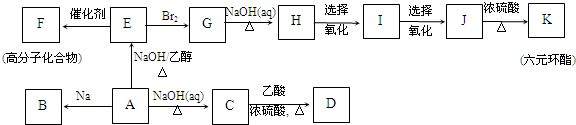
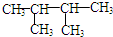 ,K为
,K为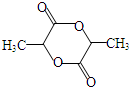 ;
;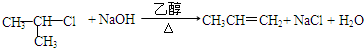 ;G→H
;G→H ;
; .
.