题目内容
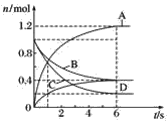
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快是
A.V(H2)==0.1 mol/(L·min)B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)D.V(N2)==0.02mol/(L·s)
【答案】D
【解析】
合成氨的反应方程式为N2+3H2![]() 2NH3,v(N2):v(H2):v(NH3)=1:3:2,以氮气的反应速率为标准,当v(H2)==0.1 mol/(L·min)时,v(N2)=
2NH3,v(N2):v(H2):v(NH3)=1:3:2,以氮气的反应速率为标准,当v(H2)==0.1 mol/(L·min)时,v(N2)= ![]() mol/(L·min);当v(NH3)==0.15mol/(L·min)时,v(N2)=0.075 mol/(L·min);v(N2)==0.02mol/(L·s)=1.2 mol/(L·min),故V(N2)==0.02mol/(L·s)的反应速率最快;
mol/(L·min);当v(NH3)==0.15mol/(L·min)时,v(N2)=0.075 mol/(L·min);v(N2)==0.02mol/(L·s)=1.2 mol/(L·min),故V(N2)==0.02mol/(L·s)的反应速率最快;
答案选D。

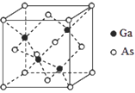
【题目】下表列出了a~m 13种元素在周期表(已省略了过渡元素)中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | a | |
2 | b | c | d | |||||
3 | e | f | g | h | i | |||
4 | j | k | l | |||||
5 | m |
(1)元素b为________(填名称);画出g的原子结构示意图__________。
(2)元素f、i、j的原子半径从大到小的顺序是____________(用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是_____________(用离子符号表示)。
(3)h和k的原子序数相差___________(填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为___________,该化合物中化学键有____________,该化合物与c的最高价氧化物反应的化学方程式为_________________。
【题目】(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
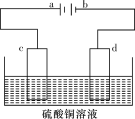
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。