题目内容
【题目】氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应式为____________________,负极反应式为___________________;若在常温下转移2mol电子,可产生水质量为_________g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L(标准状况)气体。此时氢氧燃料电池中消耗H2的质量是_______,混合溶液中NaOH的物质的量浓度是__________mol·L-1。
(3)已知可逆反应:AsO43-+2I-+2H+![]() AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
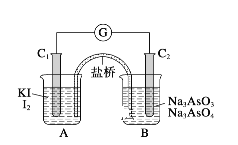
(Ⅰ)若向B中逐滴加入浓盐酸,上述反应向右进行,发现检流计指针向左偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现检流计指针与(Ⅰ)中偏转方向相反。
试回答问题:
操作(Ⅰ)中,C1棒上的反应式为_____________________________。
操作(Ⅱ)中,C2棒上的反应式为______________________________。
【答案】O2 + 4e- + 4H+ = 2H2O 2H2 - 4e- = 4 H+ 18 0.3g 1 C1棒 2I- - 2e- = I2 C2棒 AsO33- - 2e- + 2OH- = AsO43-+H2O
【解析】
(1)H2、O2燃料电池,电解质溶液为硫酸,正极氧气得电子与氢离子反应生成水,负极氢气失电子生成氢离子;
(2)阴极:Cu2++2e- =Cu,2H2O+ 2e-=2OH- +H2![]() ,阳极:2Cl- - 2e- = Cl2
,阳极:2Cl- - 2e- = Cl2![]() ;
;
(3)用平衡理论判断AsO43-+2I-+2H+![]() AsO33-+I2+H2O移动方向。
AsO33-+I2+H2O移动方向。
(1)H2、O2燃料电池,电解质溶液为硫酸,正极氧气得电子与氢离子反应生成水,负极氢气失电子生成氢离子,电极反应式分别为O2 + 4e- + 4H+ = 2H2O、2H2 - 4e- = 4H+;常温下转移2mol电子,可生成1mol水,即18g;
(2)电解由NaCl和CuSO4组成的混合溶液,阴极:Cu2++2e- =Cu,2H2O+ 2e-=2OH- +H2![]() ,c(Cu2+)=1mol/L,溶液为100mL,需要0.2mol电子;生成标准状况1.12L氢气,需要0.1mol电子,合计0.3mol,则电池的负极消耗0.15mol氢气,即0.3g;阳极:2Cl- - 2e- = Cl2
,c(Cu2+)=1mol/L,溶液为100mL,需要0.2mol电子;生成标准状况1.12L氢气,需要0.1mol电子,合计0.3mol,则电池的负极消耗0.15mol氢气,即0.3g;阳极:2Cl- - 2e- = Cl2![]() ,n(Cl-)=0.3mol,则阳极生成n(OH-)=0.1mol,则c(NaOH)=1mol/L;
,n(Cl-)=0.3mol,则阳极生成n(OH-)=0.1mol,则c(NaOH)=1mol/L;
(3)向B中逐滴加入浓盐酸,溶液中氢离子浓度增大,平衡正向进行AsO43-+2e-+2H+![]() AsO33-+H2O,则C1棒上的反应式为2I- - 2e- = I2;
AsO33-+H2O,则C1棒上的反应式为2I- - 2e- = I2;
向B中滴加40%的NaOH溶液,平衡逆向移动,C2棒发生AsO33-+2OH- -2e-![]() AsO43-+H2O。
AsO43-+H2O。



