��Ŀ����
����Ŀ����ѧ����ʽ�����뷽��ʽ�����ӷ���ʽ���Ƿdz���Ҫ�Ļ�ѧ���
��1�����³�ѹ��,��������ʮ������:
��Al��NaHSO4���Ҵ���CO2�ݴ����С�մ��Fe(OH)3��NaOH�ᰱˮ��(NH4)2SO4
����״̬�¿ɵ����������______________(���ţ���ͬ);���ڷǵ���ʵ���______________����������ʵ���________;����ˮ�еĵ��뷽��ʽΪ________��
��2������ʮ��������������������ˮ��Һ�пɷ�����Ӧ�����ӷ���ʽΪ:H++OH-=H2O,�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
��3���������ƿ���Ϊ������ߺ�DZˮͧ�еĹ�������д�����������������̼��Ӧ�Ļ�ѧ����ʽ____________��
��4����д��ʵ�����Ʊ�Fe(OH)3��������ӷ���ʽ___________��
��5����֪PbSO4������ˮ���������ڴ������Һ,��Ӧ����ʽ����:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4���ֽ�Na2S��Һ�����Ǧ��Һ����г������ɣ����䷴Ӧ�����ӷ���ʽӦΪ___________��
���𰸡� �٢� �ۢ� �ݢ� CH3COOH![]() CH3COO-+ H+ NaHSO4 + NaOH= Na2SO4 + H2O 2Na2O2 +2CO2= 2Na2CO3 + O2 Fe3++3H2O
CH3COO-+ H+ NaHSO4 + NaOH= Na2SO4 + H2O 2Na2O2 +2CO2= 2Na2CO3 + O2 Fe3++3H2O![]() 3Fe(OH)3(����)+3H+ (CH3COO)2Pb + S2-=PbS��+ 2CH3COO-
3Fe(OH)3(����)+3H+ (CH3COO)2Pb + S2-=PbS��+ 2CH3COO-
��������(1)�������ˮ��Һ������״̬�µ��磬���������ܵ��磬�����ܵ�������������Ͱ�ˮ����ˮ��Һ������״̬�¶�������Ļ�����Ϊ�ǵ���ʣ����Զ�����̼���Ҵ�Ϊ�ǵ���ʣ������������������ʣ������д������������������Ϊ���ᣬ��ˮ�в��ֵ������������Ӻ������ӣ��ʴ�Ϊ�� �٢��� �ۢ����ݢ��� CH3COOH![]() CH3COO-+ H+ ����2�������Ӵ���ǿ�������ȫ����������ӵ��������ƣ�����������ǿ����������ƣ����Ը÷�ӦΪNaHSO4 + NaOH= Na2SO4 + H2O ����3���������ƺͶ�����̼��Ӧ����̼���ƺ�����������ʽΪ��2Na2O2 +2CO2= 2Na2CO3 + O2 ����4��ʵ�����Ʊ������������������Ȼ���������Һ���뵽��ˮ�м������ȵ����ֺ��ɫֹͣ���������ӷ���ʽΪ��Fe3+ +3H2O
CH3COO-+ H+ ����2�������Ӵ���ǿ�������ȫ����������ӵ��������ƣ�����������ǿ����������ƣ����Ը÷�ӦΪNaHSO4 + NaOH= Na2SO4 + H2O ����3���������ƺͶ�����̼��Ӧ����̼���ƺ�����������ʽΪ��2Na2O2 +2CO2= 2Na2CO3 + O2 ����4��ʵ�����Ʊ������������������Ȼ���������Һ���뵽��ˮ�м������ȵ����ֺ��ɫֹͣ���������ӷ���ʽΪ��Fe3+ +3H2O![]() 3Fe(OH)3(����)+3H+ ����5��Na2S��Һ�����Ǧ��Һ����г�������˵�����߷�Ӧ��������Ǧ����������Ǧ��������ʣ����ܲ��������ʽ����Ǧ�dz��������𣬹����ӷ���ʽΪ�� (CH3COO)2Pb + S2-=PbS��+ 2CH3COO-��
3Fe(OH)3(����)+3H+ ����5��Na2S��Һ�����Ǧ��Һ����г�������˵�����߷�Ӧ��������Ǧ����������Ǧ��������ʣ����ܲ��������ʽ����Ǧ�dz��������𣬹����ӷ���ʽΪ�� (CH3COO)2Pb + S2-=PbS��+ 2CH3COO-��

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�����Ŀ����һ��ij��Һ�п��ܺ���Fe2����Mg2����Cu2����NH4����Al3���е�һ�ֻ��֡�������һ�ֵ���ɫ���岢������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ����뵭��ɫ��������ʵ����������꣩�����������Ͳ�����������ʵ����������꣩�Ĺ�ϵ������ͼ1��ʾ������д���пհף�
��1���ڸ���Һ�к��е�������_____________�����ʵ���Ũ��֮��Ϊ_______________��
��2�����ӵĵ���ɫ������________________����ѧʽ����
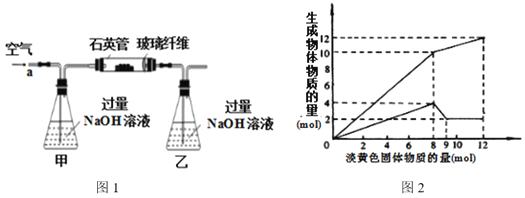
������������ʯ����Ҫ�ɷ�ΪFeS2������FeS���������������в���Fe��SԪ�أ��Ҹ����²�������ѧ�仯�������ҹ���������᳧��ȡ�������Ҫԭ�ϡ�ij��ѧ��ȤС��Ըû�����ʯ��������ʵ��̽������m1 g�û�����ʯ����Ʒ������ͼ2װ�ã��гֺͼ���װ���ԣ���ʯӢ���У���a�����ϵػ���ͨ��������������ջ�������Ʒ����Ӧ��ȫ���䷴Ӧ�Ļ�ѧ����ʽΪ��![]()
��ʵ��һ�����ⶨ��Ԫ�صĺ���
��Ӧ��������ƿ�е���Һ�������´�����
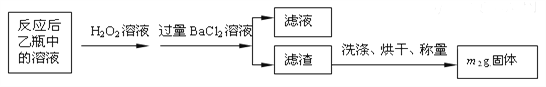
��3����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ���ǣ��û�ѧ����ʽ��ʾ��________________________________________��
��4���û�����ʯ����Ԫ�ص���������Ϊ______________���г�����ʽ���ɣ���
��ʵ��������ⶨ��Ԫ�صĺ���

��5�����У���Ҫ�õ����������ձ�������������ͷ�ι��⣬����_________________��
��6��ijͬѧһ�����������εζ�ʵ�飬ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����KMnO4��Һ���/mL | 25.00 | 25.03 | 24.97 |
�����������ݣ������ϡ��Һ��Fe2+�����ʵ���Ũ��Ϊc(Fe2+) ��_______________��