题目内容
【题目】已知有以下物质相互转化
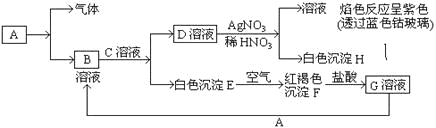
试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的实验现象是 ;向G溶液加入A的有关离子反应方程式 。
【答案】(1)FeCl2KCl (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)出现血红色溶液 2Fe3++Fe=3Fe2+
【解析】试题分析:D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化钾。
(1)通过以上分析知,B是氯化亚铁,D是氯化钾,B和D的化学式分别是:FeCl2、KCl,故答案为:FeCl2;KCl;
(2)E是氢氧化亚铁,F是氢氧化铁,氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为:4Fe (OH)2+O2+2H2O═4Fe (OH)3,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)铁离子和硫氰根离子反应生成硫氰化铁,离子反应方程式为:Fe3++3SCN-═Fe (SCN)3 ,溶液由黄色变为红色,故答案为:溶液由黄色变为红色;
(4)铁离子和铁反应生成亚铁离子,离子反应方程式为:2Fe3++Fe═3Fe2+,故答案为:2Fe3++Fe═3Fe2+。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】(一)某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图1所示。请填写下列空白:
(1)在该溶液中含有的离子是_____________,物质的量浓度之比为_______________。
(2)所加的淡黄色固体是________________(化学式)。
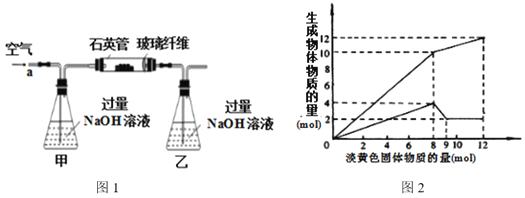
(二)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图2装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:![]()
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
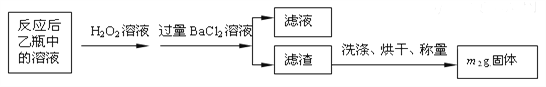
(3)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________________________________________。
(4)该黄铁矿石中硫元素的质量分数为______________(列出表达式即可)。
【实验二】:测定铁元素的含量

(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了三次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。

