题目内容
10.现有4摩尔铝及足量稀HCl和稀NaOH溶液,欲将铝全部转化为Al(OH)3,所需HCl与NaOH的物质的量之和最少应是( )| A. | 6摩尔 | B. | 4摩尔 | C. | 16摩尔 | D. | 8摩尔 |
分析 由Al制取Al(OH)3的途径有3种:
①2Al+6H+=2Al3++3H2↑,Al3++3OH-=Al(OH)3↓
②2Al+2OH-+2H2O=2AlO2-+3H2↑,AlO2-+H++H2O=Al(OH)3↓
③2Al+6H+=2Al3++3H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑,Al3++3AlO2-+6H2O=4Al(OH)3↓
已知Al为4mol,根据方程式计算,消耗的酸和碱的量.
解答 解:由Al制取Al(OH)3的途径有3种:
①2Al+6H+=2Al3++3H2↑
4mol 12mol
Al3++3OH-=Al(OH)3↓
4mol 12mol
该方案理论上需要HCl与NaOH共24mol;
②2Al+2OH-+2H2O=2AlO2-+3H2↑
4mol 4mol
AlO2-+H++H2O=Al(OH)3↓
4mol 4mol
该方案理论上需要HCl与NaOH共8mol;
③2Al+6H+=2Al3++3H2↑
1mol 3mol
2Al+2OH-+2H2O=2AlO2-+3H2↑
3mol 3mol 3mol
Al3++3AlO2-+6H2O=4Al(OH)3↓
1mol 3mol
该方案理论上需要HCl与NaOH共6mol;
则所需HCl与NaOH的物质的量之和最少应是6mol.
故选:A.
点评 本题考查了铝及其化合物的转化,侧重于物质之间反应及根据方程式的有关计算,题目难度中等,考查了学生分析问题的能力和计算能力.

练习册系列答案
相关题目
18.在下列反应中,光照对反应几乎没有影响的是( )
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 氟气与氢气的反应 | D. | 次氯酸的分解 |
15.下列从混合物中分离出其中的一种成分,所采取分离方法正确的是( )
| A. | 由于碘在酒精中的溶解度大,所以,可用酒精把碘水中的碘萃取出来 | |
| B. | 水的沸点是100℃,酒精的沸点是78.5℃,所以,可用加热蒸馏方法使含水酒精变成无水酒精 | |
| C. | 氯化钠的溶解度随着温度下降而减少,所以,用冷却法从热的含有少量硝酸钾浓溶液中得到纯净的氯化钠晶体 | |
| D. | 在实验室中,通常采用加热氯酸钾和二氧化锰的混合物方法制取氧气.我们可以用溶解.过滤的方法从反应产物中得到二氧化锰 |
2.下列实验操作正确的是( )
| A. |  点燃酒精灯 | B. | 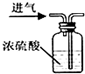 干燥氢气 | C. | 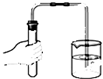 检查气密性 | D. | 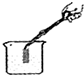 测定溶液的pH |
19.x、y、z三种元素的离子具有相同的电子层结构,离子半径x>y,y与z可形成zy2型离子化合物,则3种元素的原子序数关系是( )
| A. | x>y>z | B. | y>x>z | C. | z>x>y | D. | z>y>x |
20.实验是研究化学的基础.关于各装置图的叙述中,正确的是( )
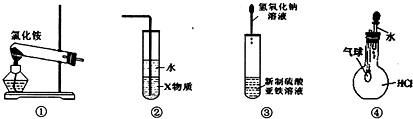

| A. | 装置①常用于实验室制取氨 | |
| B. | 装置②中X若为苯,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④可验证HCl气体在水中的溶解性 |
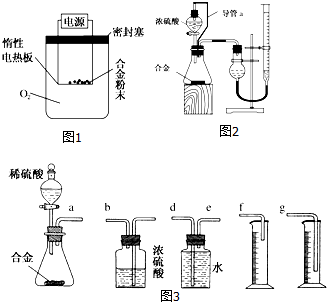 某研究性学习小组为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题.
某研究性学习小组为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题. 运用相关原理,回答下列各小题:
运用相关原理,回答下列各小题: Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.