题目内容
8.在标准状况下,CO和C2H4混合气体100L,充分烧时耗用等体积的O2,则CO与C2H4的体积比是( )| A. | 1:4 | B. | 4:1 | C. | 2:1 | D. | 1:2 |
分析 发生反应为:2CO+O2=2CO2、C2H4+3O2=2CO2+2H2O,设出气体体积,然后根据反应方程式及“完全燃烧时耗用相同体积氧气”列式计算出CO与C2H4的体积比.
解答 解:发生反应方程式为:2CO+O2=2CO2、C2H4+3O2=2CO2+2H2O,设CO的体积为xL,C2H4体积为yL,
则xLCO完全燃烧消耗氧气体积为0.5x,C2H4完全燃烧消耗氧气体积为3yL,
完全燃烧时耗用相同体积氧气,则x+y=0.5x+3y,
整理可得:x:y=4:1,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理及“完全燃烧时耗用相同体积氧气”的含义为解答关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
18.将0.2mol两种气态烃组成的混合气体完全燃烧后得到(标准状况下)6.72L二氧化碳和7.2g水,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 可能有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
16.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=20;填写表中空格:②v正<v逆 ③v正>v逆.

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(甲) | n(C) | n(D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
3.乙醇分子中不同的化学键如图.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
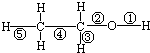

| A. | 与金属钠反应时,只有键①断裂 | B. | 在Ag催化下与O2反应时,键①、③断裂 | ||
| C. | 与CuO反应时,只有键①断裂 | D. | 与浓硫酸共热至170℃时,键②、⑤断裂 |
20.羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与C02相似,高温下分解为CO和S.下列有关说法正确的是( )
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、C02、CO、S晶体类型相同 | |
| D. | 22.4LOCS中约含有3×6.02×1023个原子 |
17.下列化合物中,属于原子晶体的是( )
| A. | CO2 | B. | NaOH | C. | SiO2 | D. | Si |
18.下列各组物质中,互为同分异构体的是( )
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 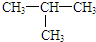 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |


 、I:
、I: .
. ;
; .
.