题目内容
【题目】已知A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可以衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示(部分反应条件、产物省略):(已知 2R-CHO + O2→2R-COOH R为烃基)
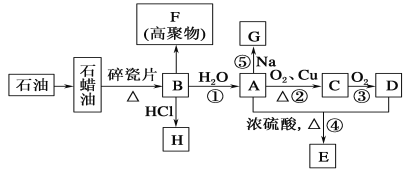
回答下列问题:
(1)①决定化合物A的化学特性的原子团的名称为________;F的结构简式为______________。
②B到A的反应类型为________,A到C的反应类型为________;
(2)写出下列反应的化学方程式:
反应②:______________________________________,
反应⑤:________________________________________。
(3)工业上制备H有以下两种方案:
Ⅰ.乙烷与氯气反应; Ⅱ.乙烯与氯化氢反应。
你认为最合理的方案是(填代号)________,理由是_________________________。
【答案】羟基 ![]() 加成反应 氧化反应 2CH3CH2OH+O2
加成反应 氧化反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑ Ⅱ 乙烷与氯气发生的是取代反应,副反应多,产物不纯,产率低;乙烯与氯化氢发生的是加成反应,产物纯净,产率高
2CH3CHO+2H2O 2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑ Ⅱ 乙烷与氯气发生的是取代反应,副反应多,产物不纯,产率低;乙烯与氯化氢发生的是加成反应,产物纯净,产率高
【解析】
根据A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,可推出A是乙醇;B的产量可以用来衡量一个国家的石油化工水平,B是乙烯;然后根据有关物质的性质逐一进行分析解答。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,可知A是乙醇;B的产量可以用来衡量一个国家的石油化工水平,则B为乙烯,结构简式是CH2=CH2,乙烯与水发生加成反应生成A为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO可进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸催化和加热条件下,发生酯化反应,反应生成乙酸乙酯和水,故E为CH3COOCH2CH3,乙烯与HCl在一定条件下发生加成反应生成H为CH3CH2Cl。CH2=CH2也可以在一定条件下发生加聚反应产生高聚物F是聚乙烯:![]() ;
;
(1)①A为CH3CH2OH,官能团是羟基,决定化合物A的化学特性的原子团的名称为羟基;F是聚乙烯,其结构简式为![]() ;
;
②CH2=CH2和水发生加成反应,产生乙醇,所以B到A的反应类型为:加成反应;乙醇与O2在Cu或Ag作催化剂条件下发生氧化反应生成C为CH3CHO,所以A到C的反应类型为氧化反应;
(2)反应②是乙醇催化氧化反应,反应的化学方程式为: 2CH3CH2OH+O2![]() 2CH3CHO
2CH3CHO
+2H2O;
反应⑤是乙醇与钠发生的置换反应,反应产生乙醇钠和氢气,反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(3)乙烷与氯气发生的取代反应是逐步进行的,首先反应产生一氯乙烷和HCl,生成的一氯乙烷会与氯气进一步反应,产生二氯乙烷、三氯乙烷等,同时每一步反应都会产生HCl,可见用这种取代反应制取氯乙烷方法,发生的副反应多,产物不纯,而且产率低;而乙烯与HCl在一定条件下发生加成反应,产生氯乙烷,不仅产物纯净,而且产率还高,故方案Ⅱ更合理。

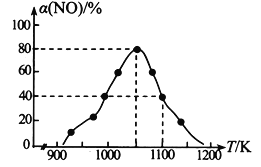
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
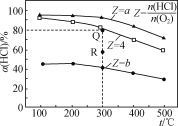
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
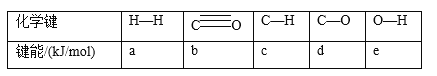
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
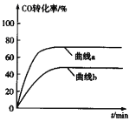
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
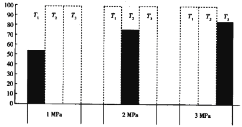
T1、T2、T3由大到小的关系是_________,判断理由是____________
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
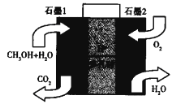
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________