题目内容
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:①饱和NaClO溶液pH为11;
②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为_________。
②盖紧瓶塞并在暗处反应的原因__________滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
【答案】分液漏斗 MnO2+2Cl-+4H+![]() Cl2↑+Mn2++2H2O NaClO、NaOH 溶液中存在平衡Cl2+H2O
Cl2↑+Mn2++2H2O NaClO、NaOH 溶液中存在平衡Cl2+H2O![]() HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大 ClO-+2I-+2H+=I2+Cl-+H2O 防止HClO分解(防止Cl2、I2逸出) 当滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟不变色 4.47
HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大 ClO-+2I-+2H+=I2+Cl-+H2O 防止HClO分解(防止Cl2、I2逸出) 当滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟不变色 4.47
【解析】
装置A中MnO2固体和浓盐酸反应生成Cl2,Cl2中含HCl气体,通过装置B中饱和食盐水除去氯化氢,通过装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,通过碳酸氢钠溶液,氯气和水反应生成的盐酸和碳酸氢钠反应,促进氯气和水反应正向进行次氯酸浓度增大,最后通过碱石灰吸收多余氯气,
(1)①由图可知仪器的名称,二氧化锰和浓盐酸反应生成氯气;
②通过装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠;
③C瓶溶液中石蕊立即褪色的原因是氯气和水反应生成的盐酸和碳酸氢钠反应,促进氯气和水反应正向进行次氯酸浓度增大;
(2)①取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,次氯酸钠在酸性溶液中氧化碘化钾生成碘单质;
②盖紧瓶塞并在暗处反应的原因是防止HClO分解;
③ClO-+2I-+2H+=I2+Cl-+H2O、I2+2S2O32-=2I-+S4O62-,ClO-~I2~2S2O32-,以此计算C瓶溶液中NaClO的含量。
(1)①仪器a的名称分液漏斗,装置A中发生反应的离子方程式为MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②氯气和装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,C瓶溶液的溶质是NaCl、NaClO、NaOH;
③C瓶溶液中石蕊立即褪色的原因是:溶液中存在平衡Cl2+H2OHCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大;
(2)①步骤I的C瓶中反应的离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O;
②紧瓶塞并在暗处反应的原因是防止HClO光照分解;通常选用淀粉溶液作指示剂,滴定至终点的现象当滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟不变色;
③由ClO-+2I-+2H+=I2+Cl-+H2O、I2+2S2O32-═2I-+S4O62-,由方程式可得关系式
NaClO~I2~2S2O32-,
1 2
n 0.1000mol/L×0.024L=0.0024mol
则n=0.0012mol,则C瓶溶液中NaClO的含量为![]() =4.47g/L。
=4.47g/L。

 阅读快车系列答案
阅读快车系列答案【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
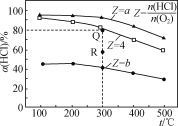
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1