题目内容
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大。)请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→___→___→__→__→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式____。
(3)能证明反应中有CO生成的现象是_____。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④中达到滴定终点的现象为_____。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
【答案】E H J H 将BCl3冷凝为液态分离出来 BCl3+3H2O=H3BO3+3HCl F中黑色固体变成红色且澄清石灰水变浑浊 酸式滴定管或移液管 当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色 ![]() B
B
【解析】
(1)干燥的氯气、B2O3、C反应生成BCl3和CO,BCl3的熔点为-107.3℃,沸点为12.5℃,收集三氯化硼要用冰水冷却,未反应的氯气用氢氧化钠溶液吸收,三氯化硼易水解,为防止氢氧化钠溶液中的水进入装置E,在E和J之间加H装置,用于吸水,生成的CO经干燥后在通过F装置还原氧化铜,再将生成的气体通过澄清的石灰水检验,可以证明原反应中有CO生成,多余的CO不能排放到空气中,要排水法收集。
(2)BCl3接触潮湿空气时会形成白雾,是三氯化硼水解生成HCl,HCl溶于空气中的水形成盐酸小液滴从而形成白雾;
(3)CO能还原氧化铜,使黑色的氧化铜生成红色的铜单质,CO自身被氧化成二氧化碳,能使澄清的石灰水变浑浊;
(4)根据Fe3+、SCN-反应产生血红色物质判断滴定终点;
(5)(6)根据n(Ag+)=n(Cl-)+n(SCN-),可计算出溶液中10.00mL溶液中含有的n(Cl-),然后计算mg即100mL中含有的n(Cl-),从而计算出其质量分数,根据v=n/V进行误差分析。据此解答。
(1)干燥的氯气、B2O3、C反应生成BCl3和CO,BCl3的熔点为-107.3℃,沸点为12.5℃,收集三氯化硼要用冰水冷却,未反应的氯气用氢氧化钠溶液吸收,三氯化硼易水解,为防止氢氧化钠溶液中的水进入装置E,在E和J之间加H装置,用于吸水,生成的CO经干燥后在通过F装置还原氧化铜,再将生成的气体通过澄清的石灰水检验,可以证明原反应中有CO生成,多余的CO不能排放到空气中,要排水法收集。则该实验装置中合理的连接顺序为G→_E__→_H__→_J_→H__→F→D→I;其中装置E的作用是将BCl3冷凝为液态分离出来。本小题答案为:E 、H 、J 、H ;将BCl3冷凝为液态分离出来。
(2)BCl3接触潮湿空气时会形成白雾,是三氯化硼水解生成HCl,HCl溶于空气中的水形成盐酸小液滴形成白雾,则三氯化硼水解的化学方程式为BCl3+3H2O=H3BO3+3HCl。本小题答案为:BCl3+3H2O=H3BO3+3HCl。
(3)CO能还原氧化铜,使黑色的氧化铜生成红色的铜单质,CO自身被氧化成二氧化碳,能使澄清的石灰水变浑浊,则能证明反应中有CO生成的现象是F中黑色固体变成红色且澄清石灰水变浑浊。本小题答案为:F中黑色固体变成红色且澄清石灰水变浑浊。
(4)步骤②移取溶液时所需仪器名称为酸式滴定管或移液管;用KSCN标准溶液滴定过量的AgNO3溶液,当硝酸银恰好反应完时,再滴入KSCN标准溶液,KSCN遇硝酸铁会生成硫氰化铁血红色溶液,则步骤④中达到滴定终点的现象为当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色。本小题答案为:酸式滴定管或移液管;当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色。
(5)消耗的硫氰化钾的物质的量为10-3C2V2mol/L,则过量的硝酸银的物质的量为10-3C2V2mol/L,则与产品中的氯离子反应的硝酸银的物质的量为(10-3C1V1-10-3C2V2)mol/L,则10.00mL该产品溶液中的氯离子的物质的量也为(10-3C1V1-10-3C2V2)mol/L,100.00mL该产品溶液中的氯离子的物质的量也为(10-2C1V1-10-2C2V2)mol/L,质量为35.5(10-2C1V1-10-2C2V2)g,产品中氯元素的质量分数为[35.5(10-2C1V1-10-2C2V2)/m]×100%,即![]() 。本小题答案为:
。本小题答案为:![]() 。
。
(6)A. 步骤③中未加硝基苯,会使一部分氯化银转化为硫氰化银,导致n(SCN-)增大,根据关系式n(Ag+)=n(Cl-)+n(SCN-)可知样品中含有的n(Cl-)偏小,故A不符合题意;
B. 步骤①中配制100mL溶液时,定容时俯视刻度线,则使c(Cl-)偏大,等体积时含有的n(Cl-)偏大,故 B符合题意;
C. 用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡,气泡占一定的体积,则读出KSCN溶液的体积偏大,消耗KSCN的物质的量偏大,根据KSCN计算出剩余的AgNO3的物质的量偏大,则与产品反应的硝酸银的物质的量偏小,则与硝酸银反应的氯离子的物质的量偏小,则测得产品中氯含量偏低,故 C不符合题意;
D. /span>滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴,消耗KSCN的物质的量偏大,根据KSCN计算出剩余的AgNO3的物质的量偏大,则与产品反应的硝酸银的物质的量偏小,则与硝酸银反应的氯离子的物质的量偏小,则测得产品中氯含量偏低,故 D不符合题意。答案选B。

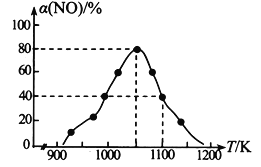
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
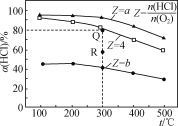
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。

(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为_________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_____________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 18 |
化学式 | _______ | ________ | ________ |
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
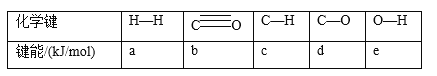
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
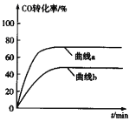
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
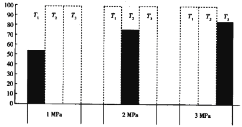
T1、T2、T3由大到小的关系是_________,判断理由是____________
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
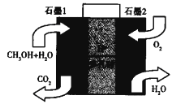
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________