��Ŀ����
����Ŀ��ij��ѧ��ȤС��ͬѧչ����Ư����������(NaClO2)���о���
ʵ�����ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38 ��ʱ�����ľ�����NaClO2��3H2O������38 ��ʱ�����ľ�����NaClO2������60 ��ʱNaClO2�ֽ��NaClO3��NaCl����������ͼ��ʾװ�ý���ʵ�顣
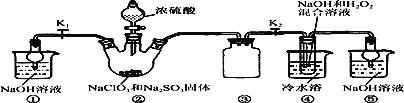
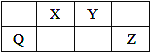
��1��װ�â۵�������__________________________��
��2��װ�â��в���ClO2�Ļ�ѧ����ʽΪ_______________________________________��װ�â����Ʊ�NaClO2�����ӷ���ʽΪ____________________________________________��
��3����װ�âܷ�Ӧ�����Һ���NaClO2����IJ�������Ϊ��
�ټ�ѹ��55 �������ᾧ���� ���ȹ��ˣ���________________���� ����60 �����õ���Ʒ��
ʵ��ⶨij����������Ʒ�Ĵ��ȡ��������ʵ�鷽����������ʵ�飺
��ȷ��ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ(��֪��ClO![]() ��4I����4H��===2H2O��2I2��Cl��)�������û��Һ���250 mL������Һ������ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L��1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2��2S2O
��4I����4H��===2H2O��2I2��Cl��)�������û��Һ���250 mL������Һ������ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L��1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2��2S2O![]() ===2I����S4O
===2I����S4O![]() )��
)��
��4�����ƴ���Һʱ�����õ��ձ����������⣬�������õ��IJ���������_________��
��5������Ʒ��NaClO2����������Ϊ__________________(�ú�m��c��V�Ĵ���ʽ��ʾ)��
���𰸡� ��ֹ����(��������ȷ˵��) 2NaClO3��Na2SO3��H2SO4===2ClO2����2Na2SO4��H2O 2OH�� ��2ClO2��H2O2===2ClO2�� ��2H2O��O2 ��38 �桫60 �����ˮϴ�� 250mL����ƿ ��ͷ�ι� ![]() %
%
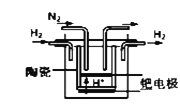
��������ʵ�������������Ϣ��֪��װ�����������Ʊ�ClO2����װ�â��ǰ�ȫƿ�����ڷ�ֹ������װ�â��������Ʊ�NaClO2����װ�����͢���β������װ�á�
��1��װ�â۵������Ƿ�ֹ������
��2��װ�â��в���ClO2�Ļ�ѧ����ʽΪ2NaClO3��Na2SO3��H2SO4===2ClO2����2Na2SO4��H2O��װ�â����Ʊ�NaClO2�����ӷ���ʽΪ2OH�� ��2ClO2��H2O2===2ClO2�� ��2H2O��O2��
��3����������Ϣ��֪��NaClO2������Һ���¶ȵ���38 ��ʱ�����ľ�����NaClO2��3H2O������38 ��ʱ�����ľ�����NaClO2������60 ��ʱNaClO2�ֽ��NaClO3��NaCl�����ԣ���װ�âܷ�Ӧ�����Һ���NaClO2����IJ�������Ϊ���ټ�ѹ��55 �棨��38 ����60 �棩�����ᾧ���� ���ȹ��ˣ�����38 ����60 �����ˮϴ������ ����60 �����õ���Ʒ��
ʵ�������ȷ��ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ(��֪��ClO![]() ��4I����4H��===2H2O��2I2��Cl��)�������û��Һ���250 mL������Һ������ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L��1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2��2S2O
��4I����4H��===2H2O��2I2��Cl��)�������û��Һ���250 mL������Һ������ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L��1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2��2S2O![]() ===2I����S4O
===2I����S4O![]() )��
)��
��4�����ƴ���Һʱ�����õ��ձ����������⣬�������õ��IJ���������250mL����ƿ�ͽ�ͷ�ι���
��5����ʵ������е�������Ӧ���Եõ���ϵʽClO![]() ~2I2~4S2O
~2I2~4S2O![]() ����n(NaClO2)=4n(Na2S2O3)=
����n(NaClO2)=4n(Na2S2O3)= ![]() ������Ʒ��NaClO2����������Ϊ
������Ʒ��NaClO2����������Ϊ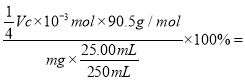
![]() %��
%��

 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�