题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]又名摩尔盐,是浅绿色晶体,易溶于水,是分析化学中的重要试剂。某化学兴趣小组对摩尔盐的一些性质进行探究。回答下列问题:
(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知________。
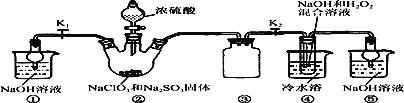
(2)摩尔盐在500℃时隔绝空气加热完全分解,气体产物可能有NH3、SO2、SO3、H2O等。兴趣小组利用下图装置证明摩尔盐分解的气体产物中有SO2和SO3。

①a的名称是________。装置B的作用________。
②装置连接顺序为A→____→____→____→____(填字母序号)。
③能证明分解产物中有SO2的实验现象是________,反应的离子方程式是________。
④若装置连接顺序不变,能否将装置E中溶液换为BaCl2溶液?理由是________。
(3)为判断摩尔盐是否变质,可以测定样品中Fe2+的含量。取w g样品溶于水,配制成250 mL溶液。每次取25.00 mL溶液,用c mol/L的酸性KMnO4溶液滴定,滴定三次,平均消耗KMnO4溶液体积 v mL。
①滴定时,用________(填“酸式”或“碱式”)滴定管盛装KMnO4溶液。
②样品中Fe2+的质量分数为________(用含w、c、v的式子表示)。
【答案】 NH4+和 Fe2+水解使溶液成酸性 硬质玻璃管 防液体倒吸入硬质玻璃管中 BEDC D 中出现白色沉淀 SO2+H2O2+Ba2+=BaSO4↓+2H+ 不能,在有 NH3存在下, SO2会与 BaCl2溶液反应生成 BaSO3沉淀, 干扰 SO3的检验 酸式 ![]()
【解析】(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知NH4+和 Fe2+水解使溶液成酸性;(2)①a的名称是硬质玻璃管。装置B为安全瓶,其作用防液体倒吸入硬质玻璃管中;②分解得到的气体进入B后再通入装置E以检验三氧化硫,再进入D以检验二氧化硫,最后尾气利用足量氢氧化钠溶液吸收,装置连接顺序为A→B→E→D→C;③能证明分解产物中有SO2的实验现象是D 中出现白色沉淀,反应的离子方程式是SO2+H2O2+Ba2+=BaSO4↓+2H+;④若装置连接顺序不变,不能将装置E中溶液换为BaCl2溶液,因为在有 NH3存在下,SO2会与BaCl2溶液反应生成 BaSO3沉淀,干扰SO3的检验;(3)①KMnO4溶液具有强氧化性会腐蚀碱式滴定管的橡胶管不能装在碱式滴定管中,滴定时,用酸式滴定管盛装KMnO4溶液;②根据反应5Fe2++ MnO4-+8H+= 5Fe3++Mn2++4H2O可知,样品中Fe2+的质量分数为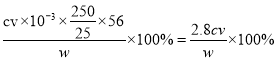 。
。

【题目】下列物质的性质与用途有关联的是
选项 | 性质 | 用途 |
A | H2能在O2中燃烧并放出大量的热 | H2用作洁净燃料 |
B | 硝酸能与苯发生取代反应 | 苯用作溶剂 |
C | 葡萄糖能与新制Cu(OH)2悬浊液反应 | 葡萄糖可用作甜味剂 |
D | 乙酸能与NaOH溶液反应 | 乙酸可用作调味剂 |
A. A B. B C. C D. D