题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为______________________(写出一种即可)。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体。则:
①反应开始时CH4与O2的物质的量之比为___________________________。
②若已知 C(s) + O2(g) = CO2(g) △H1= -m kJ/mol
CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol
则表示CH4燃烧热的热化学方程式为_____________________________________________。
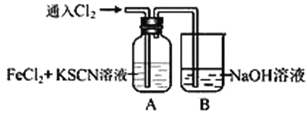
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应,
NO+NO2+Na2CO3===2NaNO2+CO2,2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为____________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是___________________。
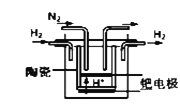
(4)氮的固定是几百年来科学家一直研究的课题
①20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如图所示,正极的电极反应式是___________________________________。
②近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)≒4NH3(g)+3O2(g),则其反应热△H=________________。
(已知:N2(g)+3H2(g)≒2NH3(g)△H=﹣92.4kJ.mol﹣1,2H2(g)+O2(g)≒2H2O(l) △H=﹣571.6kJ.mol﹣1 )
【答案】 (NH4)3PO4或(NH4)2HPO4或NH4H2PO4 ![]()
![]()
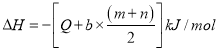 1∶7 对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应 N2+6e﹣+6H+=2NH3 +1530 kJmol﹣1
1∶7 对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应 N2+6e﹣+6H+=2NH3 +1530 kJmol﹣1
【解析】(1)由题意可知,用氨水吸收烟气中的SO2后可以得到亚硫酸铵或亚硫酸氢铵溶液,再与磷酸反应,可以生成(NH4)3PO4或(NH4)2HPO4或NH4H2PO4,故该复合肥料可能的化学式为(NH4)3PO4或(NH4)2HPO4或NH4H2PO4。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体,则剩余的气体一定是CO。
①1molCH4完全燃烧需要2mol O2,当其中b molCH4不完全燃烧生成bmol CO时,实际消耗(2-![]() )mol O2,所以,反应开始时CH4与O2的物质的量之比为
)mol O2,所以,反应开始时CH4与O2的物质的量之比为![]() 。
。
②已知① C(s) + O2(g) = CO2(g) △H1= -m kJ/mol;②CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol。根据盖斯定律,由①-②可得,2CO(g) + O2(g) = 2CO2(g) ![]() ,所以,bmol CO完全燃烧可以放出
,所以,bmol CO完全燃烧可以放出![]() 的热量,则CH4燃烧热的热化学方程式为
的热量,则CH4燃烧热的热化学方程式为![]()
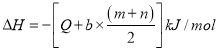 。
。
(3)① 由NO+NO2+Na2CO3===2NaNO2+CO2可知,1mol NO和1mol NO2被Na2CO3溶液完全吸收后溶液质量增加32g,同时产生1mol CO2;由2NO2+Na2CO3===NaNO2+NaNO3+CO2可知, 2mol NO2被Na2CO3溶液完全吸收后溶液质量增加48g,同时产生1mol CO2。用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则有n(NO)+n(NO2)=2mol(N的物质的量是C的2倍),32g/mol![]() n(NO)+48 g/mol
n(NO)+48 g/mol![]() [n(NO2)- n(NO)]=44g,则混合气体中n(NO) =0.25mol、n(NO2)=1.75mol,所以,NO和NO2的体积比为1:7。
[n(NO2)- n(NO)]=44g,则混合气体中n(NO) =0.25mol、n(NO2)=1.75mol,所以,NO和NO2的体积比为1:7。
② 由于NO不能与Na2CO3溶液反应,所以,用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是:对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应。
(4)①由原电池原理可知,氢气在负极上发生氧化反应生成氢离子,氮气在正极上发生还原反应,正极的电极反应式是N2+6e﹣+6H+=2NH3。
②已知:①N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1,②2H2(g)+O2(g)2H2O(l) △H=﹣571.6kJmol﹣1 。由①![]() ②
②![]() 可得2N2(g)+6H2O(l)4NH3(g)+3O2(g),则其反应热△H=(﹣92.4kJ
可得2N2(g)+6H2O(l)4NH3(g)+3O2(g),则其反应热△H=(﹣92.4kJ![]() )
)![]() =+1530 kJmol﹣1。
=+1530 kJmol﹣1。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案