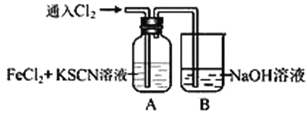
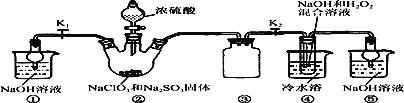
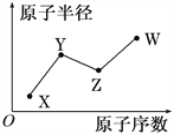
��Ŀ����
����Ŀ��A��B��C��D��E�Ǻ˵����������������ֶ���������Ԫ�أ�AԪ�ص�ԭ�Ӻ���ֻ��1�����ӣ�BԪ�ص�ԭ�Ӱ뾶����������������С�ģ�B������������Ӧˮ����Ļ�ѧʽΪHBO3��CԪ��ԭ�ӵ������������ȴ�����4����C����������D�������Ӿ�����ͬ�ĵ����Ų�����Ԫ�ؿ��γɻ�����D2C��C��Eͬ���塣
��1��D�����ڱ��е�λ��___________��
��2��Ԫ��C��D��E�γɵ�ԭ�Ӱ뾶��С��ϵ��______________����Ԫ�ط��ű�ʾ����
��3��C��D���γɻ�����D2C2��D2C2���еĻ�ѧ��������______________________��
��4��A��C����Ԫ���γɵ�ԭ�Ӹ���֮��Ϊ1:1�Ļ��������ʽ________________��
��5��B���⻯����B������������ˮ���ﷴӦ�����ӷ���ʽ_______________��
���𰸡� �������ڵڢ�A�� Na > S > O ���Ӽ������ۼ� ![]() NH3 + H+ = NH4+
NH3 + H+ = NH4+
��������AԪ�ص�ԭ�Ӻ���ֻ��1������,��AΪHԪ��;BԪ�ص�ԭ�Ӱ뾶����������������С��,B������������Ӧˮ����Ļ�ѧʽΪHBO3,��B������ϼ�Ϊ+5��,λ�����ڱ�����A��,ӦΪNԪ��;CԪ��ԭ�ӵ������������ȴ�����4��,��Cԭ��ֻ����2�����Ӳ�,����������Ϊ6,��CӦΪOԪ��;C����������D�������Ӿ�����ͬ�ĵ����Ų�,��Ԫ�ؿ��γɻ�����D2C,��D�Ļ��ϼ�Ϊ+1��,��ԭ����������OԪ��,��DΪNaԪ��;C��E����,��EΪSԪ��,�ݴ˽��н����
���:(1)DΪNaԪ��,ԭ�Ӻ�����3�����Ӳ�,����������Ϊ1,��λ�����ڱ��������ڵڢ�A��,
��ˣ�������ȷ����:�������ڵڢ�A��;
(2)ͬ������ԭ����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶��Na��S��O���ʴ�Ϊ��Na��S��O��
��ˣ�������ȷ����: Na > S > O ;
(3)Na2O2���еĻ�ѧ�������Ӽ������ۼ����ʴ�Ϊ�����Ӽ������ۼ���
��ˣ�������ȷ����:���Ӽ������ۼ�;
(4)H��O����Ԫ���γɵ�ԭ�Ӹ���֮��Ϊ1��1�Ļ�����ΪH2O2��������Oԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԡ�Oԭ��֮���γ�1�Թ��õ��Ӷԣ������ʽΪ��![]() ��
��
��ˣ�������ȷ����:![]() ��
��
(5)���������ᷴӦ��������泥���Ӧ���ӷ���ʽΪ��NH3 + H+ = NH4+
���ʴ�Ϊ��NH3 + H+ = NH4+��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�