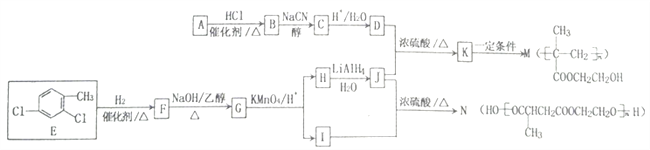
题目内容
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( ) 
A.50min时,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25min之间,pH=10时R的平均降解速率为0.04 molL﹣1min﹣1
【答案】A
【解析】解:A、根据图示可知:在50min时,pH=2和pH=7时R的降解百分率是相等的,故A正确;
B、溶液酸性越强,即pH越小,线的斜率越大,可以知道R的降解速率越大,故B错误;
C、根据图示可知:R的起始浓度越小,降解速率越小,故C错误;
D、在 20﹣25min之间,pH=10时R的平均降解速率为= ![]() ×10﹣4=0.04×10﹣4molL﹣1min﹣1,故D错误.
×10﹣4=0.04×10﹣4molL﹣1min﹣1,故D错误.
故选A.
A、根据图中的信息可以知道在50min时,pH=2和pH=7时R的降解百分率;
B、对比溶液的酸性强弱对R的降解速率的影响情况;
C、根据t=0时物质的初始浓度来判断降解速率的大小;
D、根据平均降解速率v= ![]() 来计算即可.
来计算即可.

练习册系列答案
相关题目
【题目】下列物质的性质与用途有关联的是
选项 | 性质 | 用途 |
A | H2能在O2中燃烧并放出大量的热 | H2用作洁净燃料 |
B | 硝酸能与苯发生取代反应 | 苯用作溶剂 |
C | 葡萄糖能与新制Cu(OH)2悬浊液反应 | 葡萄糖可用作甜味剂 |
D | 乙酸能与NaOH溶液反应 | 乙酸可用作调味剂 |
A. A B. B C. C D. D