题目内容
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Ni原子核外有__种运动状态不同的电子,M层的电子云有__种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Se的第一电离能低于As,原因是___。
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO2-中大π键应表示为__。
,则NO2-中大π键应表示为__。
(4)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(5)FeO是离子晶体,其晶格能可通过图中的Born—Haber循环计算得到。
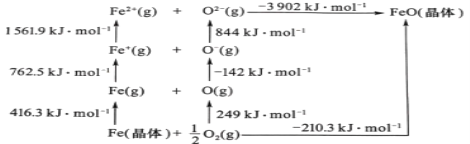
可知,O原子的第一电子亲和能为___kJmol-1,FeO晶格能为___kJmol-1。
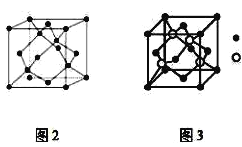
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。
),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。

(列出计算式即可)
【答案】3d34s2 28 9 Se:[Ar]3d104s24p4、As:[Ar]3d104s24p3,半充满,能量低,稳定,难失电子,因此Se的第一电离能明显低于As ![]() A 142 3902 (
A 142 3902 (![]() ,
,![]() ,
,![]() )
) 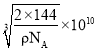
【解析】
(1)钒为23号元素,基态钒原子核外电子排布式为1s22s22p63s23p63d34s2,则其价电子排布式为3d34s2;每个电子的运动状态均不相同,基态Ni原子核外有28个电子,则有28种运动状态不同的电子,M层上能级有3s、3p、3d,则M层的电子云有9种不同的伸展方向。
(2)因为Se:[Ar]3d104s24p4、As:[Ar]3d104s24p3,半充满,能量低,稳定,难失电子,因此Se的第一电离能明显低于As。
(3)NO2-中参与形成大π键的原子数为3,则m=3,各原子的单电子数为3,得电子数为1,故n=4,可用符号![]() 表示NO2-中大π键。
表示NO2-中大π键。
(4)A.Mn3+的价电子构型为3d4,Mn3+在水溶液中容易歧化为MnO2和Mn2+,说明Mn3+不稳定,Mn3+易变成电子半充满的稳定电子构型,故3d4不属于较稳定的电子构型,A正确;
B.根据Mn2+的电子构型可知,Mn2+中价电子层不含成对电子,但内层中含有成对电子,B错误;
C.第四周期元素中价电子层中未成对电子数最多的元素价电子排布式为3d54s1,为铬元素,C错误;
D.Mn2+与Fe3+具有相同的价电子构型,微粒的化学性质不仅与价电子构型有关,也和微粒的电荷数、半径等有关,故它们的化学性质不相似,D错误;
答案选A。
(5)第一亲和能为气态基态原子获得一个电子变成气态一价负离子放出的能量,根据图示可知,O原子的第一电子亲和能为142kJmol-1;晶格能是指气态离子形成1mol离子晶体所释放的能量,故FeO晶格能为3902kJmol-1。
(6)d点在体对角线的四分之一处,与a点相对的位置,因此可以得到d点坐标参数为(![]() ,
,![]() ,
,![]() ),铜原子位于晶胞体内,个数为4,氧原子位于晶胞的顶点和体内,个数为
),铜原子位于晶胞体内,个数为4,氧原子位于晶胞的顶点和体内,个数为![]() ,故化学式为Cu2O,根据体积公式
,故化学式为Cu2O,根据体积公式 ,则晶胞的参数为
,则晶胞的参数为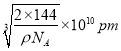 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案