题目内容
【题目】请回答下列问题:
(1)根据题意选择以下四种物质的字母序号填空
A:Si B:Na2SiO3 C:Ca(ClO)2 D:KAl(SO4)2·12H2O
①漂白粉的有效成分是___。
②可用于制备硅胶和木材防火剂的是___。
③可用于制计算机芯片的是___。
④可用于作净水剂的是___。
(2)8.4gNaHCO3正好与20mL盐酸完全反应。此盐酸的物质的量浓度是___,产生的CO2在标准状况下的体积是___L。
(3)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①请用“单线桥”标明该反应电子转移的方向与数目___。
②该反应中氧化剂是___;当有1molNa2FeO4生成,转移的电子有___mol。
【答案】C B A D 5mol/L 2.24 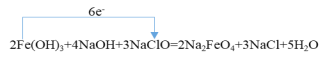 NaClO 3
NaClO 3
【解析】
(1).物质的化学性质或物理性质会决定物质相应的用途,解答此题需要识记物质相应的性质。
(2).已知NaHCO3的质量,可求得其物质的量,又NaHCO3与20mL盐酸完全反应了,再根据碳酸氢钠与盐酸反应方程式解答此题。
(3).由制取高铁酸钠反应方程式可知此反应为氧化还原过程,其中Fe(OH)3为还原剂在反应中Fe失去电子化合价升高。NaClO为氧化剂,Cl得到电子。
(1).①漂白粉的有效成分为Ca(ClO)2,通过反应产生次氯酸,从而使漂白粉具备杀菌消毒作用,答案选C。
②硅胶是一种硅酸凝胶,可由Na2SiO3加酸制取,同时Na2SiO3不燃不爆性质稳定,可作为防火剂,答案选B。
③Si属于半导体材料,计算芯片由硅晶圆制得,答案选A。
④KAl(SO4)2·12H2O溶于水,其中Al3+可水解生成氢氧化铝胶体,氢氧化铝胶体吸附水中杂质而聚沉,从而起到净水作用,答案选D。
(2).根据分析,先计算出n(NaHCO3) =8.4g/(23+1+12+48)g.mol-1 =0.1mol,NaHCO3 + HCl = NaCl + CO2 ↑+H2O此过程完全反应,则由该方程计算得n(HCl) =0.1mol,从而c(HCl) =0.1mol/0.02L =5mol/L。产生n(CO2) =0.1mol,标况下得V(CO2) =0.1mol ×22.4L/mol =2.24L。故答案为5mol/L,2.24。
(3).①根据分析,电子转移方向为Fe(OH)3→ NaClO,转移6e-。答案为 。
。
②由分析可知,氧化剂为NaClO,反应过程Fe的化合价+3→+6,则生成1molNa2FeO4转移电子数为3mol。答案为NaClO,3。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案