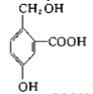
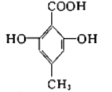
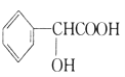
题目内容
【题目】炽热的炉膛内有反应:![]() 往炉膛内通入水蒸气时,有如下反应:
往炉膛内通入水蒸气时,有如下反应:![]() ,
,![]() ,
,![]() ,其能量变化示意图如下,
,其能量变化示意图如下,

已知CO的燃烧热为![]() 。下列有关说法正确的是
。下列有关说法正确的是![]()
A.![]()
B.![]() 的燃烧热为
的燃烧热为![]()
C.在反应![]() 中,反应物总键能大于生成物总键能
中,反应物总键能大于生成物总键能
D.往炽热的炉膛内通入水蒸气可节省燃料
【答案】C
【解析】
A.根据图象可知,1mol碳完全燃烧生成1mol二氧化碳气体时放热392KJ,故热化学方程式为![]() ,故A错误;
,故A错误;
B.根据图象和题干可知:![]() ;
;![]() ,将反应
,将反应![]() 可得
可得![]() ,而燃烧热必须生成的是液态水,故H
,而燃烧热必须生成的是液态水,故H![]() 的燃烧热不是
的燃烧热不是![]() ,故B错误;
,故B错误;
C.根据反应![]() ;
;![]() ;
;![]() ,根据盖斯定律,将
,根据盖斯定律,将![]() 可得:
可得:![]() ,而
,而![]() 反应物中的键能之和
反应物中的键能之和![]() 生成物中的键能之和,故反应物中的键能之和大于生成物中的键能之和,故C正确;
生成物中的键能之和,故反应物中的键能之和大于生成物中的键能之和,故C正确;
D.反应的热效应取决于反应的始态和终态,与反应的路径无关,故往炽热的炉膛内通入水蒸气不能节省燃料,故D错误。
故选C。

【题目】液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。请回答下列问题:
Ⅰ.已知反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 946 | 391 |
(1)反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
(2)已知:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
则△H1、△H2、△H3三者之间的关系为:△H3= ______________ ;
Ⅱ.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,工作原理如图所示。
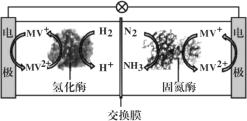
(3)负极的电极反应式为_______________;
(4)当电路中通过3mol电子时,可产生氨气的体积(标况下)为_______L;正极区中n(H+)______(填“增加”、“减少”或“不变”);
(5)该装置在高温下不能正常工作,原因是_____。