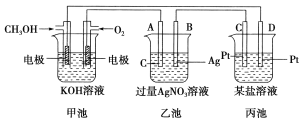
��Ŀ����
����Ŀ���������㷺Ӧ���������������ϡ���������ȣ���ҵ�Ͼ����������£�
��֪������������ɫ���ᾧ��������ˮ���Ҵ��������ڱ�ͪ����������������������
���۵�73�棬��135��ʱ�ֽ⡣
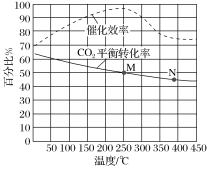
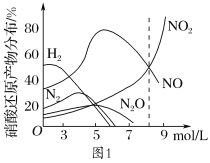
�����������Ӧ�Ļ�ԭ����ֲ���ͼ1��
ij��ȤС����ʵ������ȡ����������ش�
��1���ӹ�ҵ�����Ƕȿ���ϡ��������Ũ�ȷ�ΧΪ________ mol��L��1����Ӧ2�е����ӷ���ʽ____________��
��2������˵����������________��
A ��Ӧ1�м����NaOH��Һ�������ۺ�����Ĥ������Ҫ����
B û����գ�Ҳ����ˮԡ��������������ֹAl(NO3)3�ķֽ�
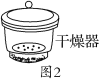
C Al��NO3��3��9H2O����ʱ���ɷ�����ͼ2�ĸ������У������·���Ũ������ˮ�������������ϴ�Ҫ������ֱ����������
D ��ȡ���Al(NO3)3�����ܷⱣ��
��3��Al(NO3)3��9H2OҲ���Ժ�SOCl2��Ӧ����������Al(NO3)3���������ﶼ���������壬�йصķ���ʽ��______________��
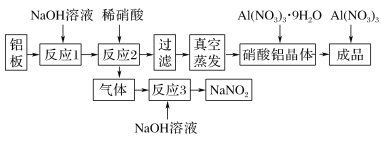
��4�������Ʊ�Al(NO3)3��װ����ͼ3��
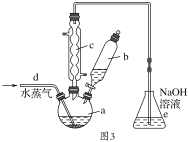
��ͨ��ˮ����������������¶Ⱥ�________��
��e�к��ѳ���β����������_______________�� Al(NO3)3��9H2O��������HNO3�����ʵ�ϴ�Ӽ���________��
��������ΪC���������Ƕ���ģ����ṩ�����ɿ�����___________��
���𰸡�8��8.5 4Al��18H����6NO3-=4Al3����3NO����3NO2����9H2O D Al(NO3)3��9H2O��9SOCl2=Al(NO3)3��9SO2����18HCl�� ���� ����HNO3�ڷ�Ӧ������Ũ�Ȳ��ϱ仯��NO��NO2���ʵ���֮�Ȳ�һ����1��1 ��ˮ ͨ���ˮ����������������ʹŨ��Ѹ���½�����Ӧ����Ѹ�ٱ�С
��������
��1���ڷ�Ӧ�����У���Ӧ�����Ļ�����Ⱦ����ΪNO��NO2��N2O��Ϊ���ٶԻ�������Ⱦ���ӷ�Ӧ����ʽNO��NO2��2NaOH==2NaNO2��ȷ��NO��NO2�������ϵ���Ӷ���ͼ���ҵ�ϡ��������Ũ�ȷ�Χ����Ӧ�ķ�Ӧ2�У�ȷ��NO��NO2�������ϵ��Ҳ��ȷ�������ʵ�����ϵ���Ӷ�ȷ����ԭ���P��Թ�ϵ��Ҳ����д����Ӧ�����ӷ���ʽ��
��2��A.NaOH��Һ������ȥ�����ۺ�����Ĥ��Ҳ����Al��Ӧ��
B.û����գ�Ҳ����ˮԡ���������������ڷ�ֹAl(NO3)3�ֽ��ͬʱ��ҲҪ��ֹˮ�ⷴӦ�ķ�����
C.������������һ��Ź轺��ˮ��Ũ������ˮ����̫ǿ���ᵼ�¾���ʧȥ���еĽᾧˮ��
D.��ȡ���Al(NO3)3����ˮ�������ܷⱣ�档
��3���˷�Ӧʵ����ˮ��SOCl2��Ӧ���ӻ��ϼۿ��ǣ�ֻ������SO2��HCl��
��4����ͨ��ˮ��������������¶Ȼ�����������ϡ����Ӵ���������ã�
��NO��NO2�����ʵ���֮�Ȳ�һ����1��1��
Al(NO3)3��9H2O��������HNO3�������л���л��ﲻ�ܳ�ȥ������HNO3��
�۴ӷ����������Ƕ���ķ����ǣ�ͨ���ˮ����������������ʹŨ��Ѹ���½���
��1�������������Ӧ�Ļ�ԭ����ֲ�ͼ��������8��8.5 mo l��L��1ʱ��NO��NO2��1��1�������ױ�NaOH���գ���Ӧ�ķ���ʽΪNO��NO2��2NaOH===2NaNO2����Ӧ�ķ�Ӧ2�����ӷ���ʽ��4Al��18H����6NO![]() ==4Al3����3NO����3NO2����9H2O����Ϊ��8��8.5��4Al��18H����6NO3-=4Al3����3NO����3NO2����9H2O��
==4Al3����3NO����3NO2����9H2O������8��8.5��4Al��18H����6NO3-=4Al3����3NO����3NO2����9H2O��
��2��A.NaOH��Һ�������ۺ�����Ĥ��ҲҪ��Al��Ӧ������Ӧ������A����ȷ��
B.û����գ�Ҳ����ˮԡ��������������Ҫ��ֹAl(NO3)3�ķֽ⣬ҲҪ��ֹ����ˮ�⣬B����ȷ��
C.������������һ��Ź轺��ˮ����ʱ��Ҫ����ƽ�Ʋ����ǣ�C����ȷ��
D.��ȡ���Al(NO3)3�����ܷⱣ�棬��ˮ�⣬D��ȷ����Ϊ��D��
��3���˷�Ӧʵ����ˮ��SOCl2��Ӧ���ӻ��ϼۿ��ǣ�ֻ������SO2��HCl����Ӧ�ķ���ʽΪAl(NO3)3��9H2O��9SOCl2=Al(NO3)3��9SO2����18HCl������Ϊ��Al(NO3)3��9H2O��9SOCl2=Al(NO3)3��9SO2����18HCl����
��4����ͨ��ˮ��������������¶Ȼ��������ã���Ϊ�����裻
������ˮ����ͨ��ͷ�Ӧ��HNO3��Ũ�Ȳ��ϱ仯��NO��NO2�����ʵ���֮�Ȳ���1��1�����ѱ�NaOH���ոɾ�����Ϊ������HNO3�ڷ�Ӧ������Ũ�Ȳ��ϱ仯��NO��NO2���ʵ���֮�Ȳ�һ����1��1��
Al(NO3)3��9H2O��������HNO3�����ʵ�ϴ�Ӽ�����ˮ�������л���л��ﲻ�ܳ�ȥ������HNO3����Ϊ����ˮ��
�۴ӷ����������Ƕ���ķ����ǣ�ͨ��ˮ����������������ʹŨ��Ѹ���½�����Ӧ����Ѹ�ٱ�С����Ϊ��ͨ��ˮ����������������ʹŨ��Ѹ���½�����Ӧ����Ѹ�ٱ�С��