题目内容
14.下列各组元素的原子序数中,其相应的元素原子能形成XY2型共价化合物的是( )| A. | 3与8 | B. | 6与8 | C. | 1与16 | D. | 12与17 |
分析 根据物质的化学式为XY2,可判断X的化合价可能为+2价或+4价,Y的化合价可能为-1价或-2价,根据常见元素的化合价以及是否共价化合物进行推断.
解答 解:A.3号元素为Li,8号元素为O,形成的化合物为Li2O,不符合XY2 ,故A错误;
B.原子序数为为6的元素为C,原子序数为8的元素为0,二者生成CO2,为共价化合物,故B正确;
C.1号元素为H,16号元素为S,形成的化合物H2S,不符合XY2 ,故C错误;
D.12号元素为Mg,17号元素为Cl,形成的化合物为MgCl2,符合XY2 ,但MgCl2 为离子化合物,故D错误.
故选B.
点评 本题考查了化学键的判断,知道原子序数对应的元素是解本题关键,根据形成化学键特点再结合基本概念来分析解答,注意离子键和共价键的区别,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
4.下列叙述中正确的是( )
| A. | 液态HCl、固体NaCl均不导电,所以HCl和NaCl均是非电解质 | |
| B. | NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质 | |
| C. | 常见的酸、碱和大部分盐都是强电解质 | |
| D. | 强电解质与弱电解质的本质区别,是其在水溶液中的电离程度不同 |
5.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
| A. |
| B. |
| C. |
| D. |
|
2. 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )| A. | $\root{3}{\frac{2M}{p{N}_{A}}}$cm | B. | $\root{3}{\frac{M}{2p{N}_{A}}}$cm | C. | $\root{3}{\frac{2{N}_{A}}{pM}}$cm | D. | $\root{3}{\frac{M}{8p{N}_{A}}}$cm |
9.含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫强 | B. | 原子序数为34 | ||
| C. | 氢化物比HBr稳定 | D. | 最高价氧化物的水化物显碱性 |
6.现有烃的含氧衍生物A,还原A时得醇B,氧化A时得C,由B、C反应可生成高分子化合物,其结构简式为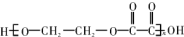 ,以下叙述错误的是( )
,以下叙述错误的是( )
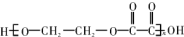 ,以下叙述错误的是( )
,以下叙述错误的是( )| A. | A属于醛类 | |
| B. | A有相对分子质量为58 | |
| C. | A分子中有6个原子含C 40% | |
| D. | 1molA与足量银氨溶液反应还原出4molAg |
3.在一密闭容器中进行反应2SO2+O2?2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为2mol•L-1、1mol•L-1、2mol•L-1.当反应达到平衡时,容器内各物质的浓度可能为( )
| A. | SO2为4 mol•L-1、O2为2 mol•L-1 | B. | SO3为4 mol•L-1 | ||
| C. | SO2为2.5 mol•L-1 | D. | SO2、SO3为1.5 mol•L-1 |