题目内容
9.用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式.(1)Ag(Al) 所选试剂:盐酸或硫酸等;离子方程式:2Al+6H+=2Al3++3H2↑.
(2)BaCl2(MgCl2) 所选试剂:Ba(OH)2溶液;离子方程式:Mg2++2OH-=Mg(OH)2↓.
(3)Na2SO4(Na2CO3) 所选试剂:硫酸;离子方程式:2H++CO32-=CO2↑+H2O.
(4)O2(Cl2) 所选试剂:NaOH溶液;离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
分析 (1)Al与盐酸、硫酸等反应,而Ag不能;
(2)氯化镁与氢氧化钡反应生成氯化钡和氢氧化镁沉淀;
(3)碳酸钠与硫酸反应生成硫酸钠、水、二氧化碳;
(4)氯气与NaOH溶液反应,而氧气不能.
解答 解:(1)Al与盐酸、硫酸等反应,而Ag不能,则除杂试剂为盐酸或硫酸等,离子反应为2Al+6H+=2Al3++3H2↑,故答案为:盐酸或硫酸等;2Al+6H+=2Al3++3H2↑;
(2)氯化镁与氢氧化钡反应生成氯化钡和氢氧化镁沉淀,则除杂试剂为Ba(OH)2溶液,离子反应为Mg2++2OH-=Mg(OH)2↓,
故答案为:Ba(OH)2溶液;Mg2++2OH-=Mg(OH)2↓;
(3)碳酸钠与硫酸反应生成硫酸钠、水、二氧化碳,则除杂试剂为硫酸,离子反应为2H++CO32-=CO2↑+H2O,故答案为:硫酸;2H++CO32-=CO2↑+H2O;
(4)氯气与NaOH溶液反应,而氧气不能,则除杂试剂为NaOH溶液,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:NaOH溶液;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查离子反应及混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重元素化合物知识及分析应用能力的考查,题目难度不大.

练习册系列答案
相关题目
17.在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q
⑥单位时间内m molA断键反应,同时pmolC也断键反应
⑦体系的密度不再变化.
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q
⑥单位时间内m molA断键反应,同时pmolC也断键反应
⑦体系的密度不再变化.
| A. | ③④⑤⑥ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ③④⑥⑦ |
4.下列叙述中正确的是( )
| A. | 液态HCl、固体NaCl均不导电,所以HCl和NaCl均是非电解质 | |
| B. | NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质 | |
| C. | 常见的酸、碱和大部分盐都是强电解质 | |
| D. | 强电解质与弱电解质的本质区别,是其在水溶液中的电离程度不同 |
14.在实验室进行下列实验,括号内的实验仪器、试剂都能用到的是( )
| A. | 乙炔的制备(蒸馏烧瓶、温度计、分液漏斗) | |
| B. | 蛋白质的盐析(试管、醋酸铅溶液、鸡蛋清溶液) | |
| C. | 蔗糖的水解(试管、蔗糖溶液、稀硫酸) | |
| D. | 肥皂的制取(蒸发皿、玻璃棒、甘油) |
18. 共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量 B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量 D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.
 共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量 B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量 D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.
 ,分子的立体构型是平面三角形.
,分子的立体构型是平面三角形. ,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).
,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).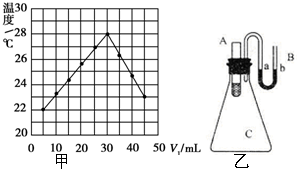 实验题:将V1 mL 1.0mol•L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空:
实验题:将V1 mL 1.0mol•L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空: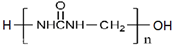 )可用于胶合板、刨花板等人造板材的生产及室内装修,但在使用过程中会释放出有毒物质,请写出合成该物质的单体的结构简式:CO(NH2)2、HCHO.
)可用于胶合板、刨花板等人造板材的生产及室内装修,但在使用过程中会释放出有毒物质,请写出合成该物质的单体的结构简式:CO(NH2)2、HCHO.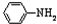 )具有碱性.(选填“酸性”、“碱性”或“中性”)
)具有碱性.(选填“酸性”、“碱性”或“中性”)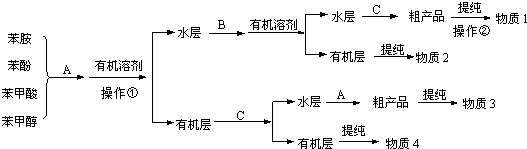
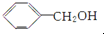 ,操作②的名称为重结晶.
,操作②的名称为重结晶.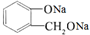 转化为
转化为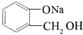 ,所选择的最佳试剂为H2O.
,所选择的最佳试剂为H2O.