题目内容
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)准确配制0.20mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有____________________
(2)根据以上数据可以计算出盐酸的物质的量浓度为_____________mol·L-1.
(3)用0.20mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视 _______________,直到滴定终点。
(4)达到滴定终点的标志是_______________________________________________________
(5)以下操作造成测定结果偏高的原因可能是__________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
【答案】250mL容量瓶、胶头滴管 0.1448 mol/L 锥形瓶内溶液颜色的变化 无色变粉红色且30s不变色 AD
【解析】
根据酸碱中和滴定的原理和操作步骤解答。
(1)准确配制0.20mol·L-1的氢氧化钠溶液250mL,还必须用到的仪器有250mL容量瓶,胶头滴管。
(2)由表格记录的数据可知:2次消耗NaOH溶液体积分别为18.50mL和17.70mL,平均消耗NaOH溶液的体积为![]() =18.10mL,设待测盐酸的浓度为c(HCl),根据方程式计算:
=18.10mL,设待测盐酸的浓度为c(HCl),根据方程式计算:
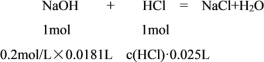
列比例式:![]() =
=![]() ,解得c(HCl)=0.1448mol/L。
,解得c(HCl)=0.1448mol/L。
(3)滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到滴定终点。
(4)盐酸中滴入酚酞时溶液显无色,当到达滴定终点时锥形瓶中溶液由无色变为粉红色,且30s不变色。
(5)A.未用标准液润洗碱式滴定管,使装入滴定管中的NaOH溶液浓度偏低,滴定结束时消耗NaOH溶液的体积[V(NaOH)aq]将偏大,根据c(HCl)=![]() 可知盐酸的浓度偏大,A项正确;B.滴定管越往上刻度值越小,俯视读数时读取的NaOH溶液体积[V(NaOH)aq]偏小,根据c(HCl)=
可知盐酸的浓度偏大,A项正确;B.滴定管越往上刻度值越小,俯视读数时读取的NaOH溶液体积[V(NaOH)aq]偏小,根据c(HCl)=![]() 可知盐酸的浓度偏小,B项错误;C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对盐酸浓度没有影响,C项错误;D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,则NaOH溶液体积[V(NaOH)aq]读数偏大,根据c(HCl)=
可知盐酸的浓度偏小,B项错误;C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对盐酸浓度没有影响,C项错误;D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,则NaOH溶液体积[V(NaOH)aq]读数偏大,根据c(HCl)=![]() 可知盐酸的浓度偏大,D项正确;答案选AD。
可知盐酸的浓度偏大,D项正确;答案选AD。