题目内容
【题目】氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJmol-1
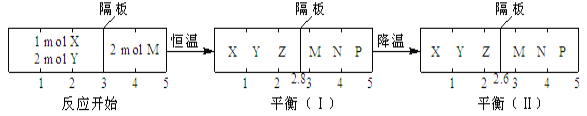
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图

①已知T2>T1,则反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
【答案】-244.1 < bc 0.025 mol·L-1·min-1 4/45(或0.089) A 催化剂活性随温度升高而增大,使NOx去除反应速率迅速增大;温度升高,反应速率加快 催化剂活性下降(或NH3与O2反应生成了NO)
【解析】
(1)根据盖斯定律计算△H;
(2)①可逆反应升高温度平衡向吸热反应方向移动;
②为提高反应速率同时提高NO的转化率,需要改变条件平衡正向进行;
③在密闭容器中充入10molCO和8molNO,发生反应,压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,NO体积分数为25%,结合三行计算列式计算,v(N2)=△c/△t,该温度下平衡常数Kp=生成物平衡分压幂次方乘积/反应物平衡分压幂次方乘积;
④若在D点升温的同时扩大体积至体系压强减小,则平衡会正向移动,NO的体积分数增大;
(3)①在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低;
②在温度、催化剂条件下,氨气能被催化氧化生成NO。
(1)已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
由盖斯定律可知,②-①2-③2得2N2O(g)=2N2(g)+O2(g),则△H=-114.14 kJmol-1 -(+180.5kJ·mol-1)2-(-115.52kJmol-1)2=-244.1kJ·mol-1,则反应2N2O (g)=2N2(g)+O2(g) △H=-244.1kJmol-1;
(2)①已知T2>T1,由图示可知反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),升高温度后,平衡后NO的体积分数增大,说明升高温度,平衡逆向移动,逆反应方向为吸热反应,则△H<0;
2N2(g)+2CO2(g),升高温度后,平衡后NO的体积分数增大,说明升高温度,平衡逆向移动,逆反应方向为吸热反应,则△H<0;
②2CO(g)+2NO(g)![]() N2(g+2CO2(g)△H<0;
N2(g+2CO2(g)△H<0;
a.改用高效催化剂加快反应速率,平衡不变,转化率不变,故a不能同时提高反应速率和NO的转化率;
b.缩小容器的体积,体系内压强增大,反应速率增大,平衡正向进行,NO的转化率增大,故b能同时提高反应速率和NO的转化率;
c.增加CO的浓度反应速率增大,平衡正向进行,NO的转化率增大,故c能同时提高反应速率和NO的转化率;
d.升高温度反应速率增大,反应为放热反应,升温平衡逆向进行,NO的转化率减小,故d不能同时提高反应速率和NO的转化率;故选bc;
③在密闭容器中充入10molCO和8molNO,发生反应,压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,NO体积分数为25%,结合三行计算列式计算,设反应生成氮气物质的量为x,
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=-749 kJ·mol-1;
N2(g)+2CO2(g)△H=-749 kJ·mol-1;
起始量(mol) 10 8 0 0
变化量(mol) 2x 2x x 2x
平衡量(mol) 10-2x 8-2x x 2x
(8-2x)/(10-2x+8-2x+x+2x)×100%=25%,x=2mol,v(N2)=△c/△t=2mol/(4L×20min)=0.025 mol·L-1·min-1;
平衡气体总物质的量=16mol,该温度下平衡常数Kp=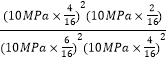 =0.089(MPa)-1;
=0.089(MPa)-1;
④若在D点升温的同时扩大体积至体系压强减小,则平衡会逆向移动,NO的体积分数增大,重新达到的平衡状态可能是图中A点;
(3)在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低,根据图知:
①催化剂活性随温度升高而增大,使NOx去除反应速率迅速增大;温度升高,反应速率加快.
②在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性下降;(或在温度、催化剂条件下,氨气能被催化氧化生成NO),

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)准确配制0.20mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有____________________
(2)根据以上数据可以计算出盐酸的物质的量浓度为_____________mol·L-1.
(3)用0.20mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视 _______________,直到滴定终点。
(4)达到滴定终点的标志是_______________________________________________________
(5)以下操作造成测定结果偏高的原因可能是__________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________。
(2)已知在一定温度下:
①C(s)+CO2(g) ![]() 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) ![]() CO(g)+H2(g)△H3 平衡常数K3。
CO(g)+H2(g)△H3 平衡常数K3。
则K1、K2、K3之间的关系是:________,△H3=________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________。