题目内容
【题目】重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO、Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
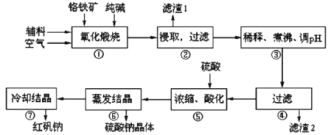
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________。
(2)“③”中调节pH至4.7,目的是________。
(3)“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式:________。
,请写出该平衡转化的离子方程式:________。
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶(锥形瓶)中,加入10mL2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定(I2+2![]() =2I-+
=2I-+![]() )。
)。
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,所得产品的中Na2Cr2O7的纯度(设整个过程中其它杂质不参与反应)________。
【答案】使反应物接触更充分,加快反应速率 除去溶液中的![]() 、
、![]()
![]() 当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不恢复 0.8384(或83.84%)
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不恢复 0.8384(或83.84%)
【解析】
铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧,根据题目信息可知煅烧后的固体主要成分有Na2CrO4、Fe2O3、Na2SiO3、NaAlO2以及MgO,水浸后过滤除去难溶物Fe2O3和MgO;稀释后调节pH至4.7,除去溶液中的AlO![]() 、SiO
、SiO![]() ,过滤后用硫酸酸化,再经加热浓缩、蒸发结晶得到硫酸钠晶体,再冷却结晶得到重铬酸钠。
,过滤后用硫酸酸化,再经加热浓缩、蒸发结晶得到硫酸钠晶体,再冷却结晶得到重铬酸钠。
(4)该滴定实验的原理是:先用酸化的重铬酸钠氧化碘离子生成碘单质,之后加入淀粉指示剂,淀粉遇碘变蓝,所以此时溶液呈蓝色;之后加入Na2S2O3标准溶液将碘单质还原,滴定终点碘单质被完全消耗,溶液蓝色褪去;根据消耗的Na2S2O3标准液可以计算得出被氧化生成的碘单质的量,从而确定重铬酸钠的量。
(1)固体反应物在搅拌时可充分接触而加快反应速率;
(2)根据分析可知调节pH至4.7,可使SiO![]() 、AlO
、AlO![]() 生成H2SiO3、Al(OH)3沉淀过滤除去;
生成H2SiO3、Al(OH)3沉淀过滤除去;
(3)CrO42-在酸性条件下与H+离子反应生成Cr2O72-,该反应为可逆反应,反应的离子方程式为![]() ;
;
(4)①碘单质被硫代硫酸钠还原为碘离子,碘离子不能使淀粉变蓝,据此可知滴定终点的现象应为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不恢复;
②![]() 氧化Iˉ时自身被还原成Cr3+,根据电子守恒可知6n(Na2Cr2O7·2H2O)=n(Iˉ),根据反应方程式I2+2
氧化Iˉ时自身被还原成Cr3+,根据电子守恒可知6n(Na2Cr2O7·2H2O)=n(Iˉ),根据反应方程式I2+2![]() =2I-+
=2I-+![]() 可知n(Iˉ)=n(
可知n(Iˉ)=n(![]() ),所以6n(Na2Cr2O7)= n(
),所以6n(Na2Cr2O7)= n(![]() ),则25.00mL试样溶液中n(Na2Cr2O7·2H2O)=
),则25.00mL试样溶液中n(Na2Cr2O7·2H2O)=![]() =0.0008mol,则试样中n(Na2Cr2O7)=0.0008mol×
=0.0008mol,则试样中n(Na2Cr2O7)=0.0008mol×![]() =0.008mol,所以试样中重铬酸钠的纯度为
=0.008mol,所以试样中重铬酸钠的纯度为![]() =83.84%。
=83.84%。

【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如图:
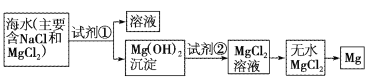
(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | 海水中镁离子浓度小,沉淀剂的用量大,不经济 |
方法2:高温加热蒸发海水后,再加入沉淀剂 | 不正确 | (一) |
你认为最合理的其他方法是:(二) | ||
(一)___;
(二)___;
(2)框图中加入的试剂①应该是___(填化学式);加入的试剂②是___(填化学式);工业上由无水MgCl2制取镁的化学方程式为___。
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是___。