题目内容
【题目】某兴趣小组进行下列实验:
①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH![]() 可能是④中沉淀溶解的原因
可能是④中沉淀溶解的原因
【答案】C
【解析】
A. 步骤①得到Mg(OH)2、NaOH、NaCl混合物, 存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),滤液含少量Mg2+,A正确;
Mg2+(aq)+2OH-(aq),滤液含少量Mg2+,A正确;
B. 浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),B正确;
Mg2+(aq)+2OH-(aq),B正确;
C. ③能说明Fe(OH)3比Mg(OH)2难溶,但②中还有NaOH,也可以生成Fe(OH)3,故不能说明,C错误;
D.因NH![]() 发生水解,溶解呈酸性,导致Mg(OH)2沉淀溶解,故NH
发生水解,溶解呈酸性,导致Mg(OH)2沉淀溶解,故NH![]() 是沉淀溶解的原因,D正确。
是沉淀溶解的原因,D正确。
答案选C。

【题目】重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO、Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
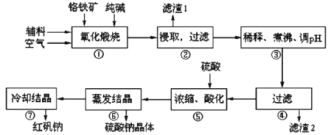
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________。
(2)“③”中调节pH至4.7,目的是________。
(3)“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式:________。
,请写出该平衡转化的离子方程式:________。
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶(锥形瓶)中,加入10mL2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定(I2+2![]() =2I-+
=2I-+![]() )。
)。
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,所得产品的中Na2Cr2O7的纯度(设整个过程中其它杂质不参与反应)________。