题目内容
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
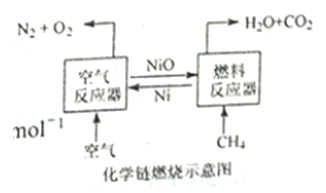
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
【答案】C
【解析】已知:①2Ni(s)+O2(g)=2NiO(s)△H1=-479.8 kJ·mol-1
②CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H2=akJ·mol-1
③CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H3=b kJ·mol-1
④CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H4=+156.9 kJ·mol-1
A. 根据盖斯定律,由②![]() ③得反应CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1,选项A正确;B. 根据盖斯定律,由①
③得反应CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1,选项A正确;B. 根据盖斯定律,由①![]() ④得反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1,选项B正确;C. 甲烷在“燃料反应器”中反应时不是甲烷的燃烧反应,不产生淡蓝色火焰,选项C错误;D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收,选项D正确。答案选C。
④得反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1,选项B正确;C. 甲烷在“燃料反应器”中反应时不是甲烷的燃烧反应,不产生淡蓝色火焰,选项C错误;D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收,选项D正确。答案选C。

【题目】重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO、Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
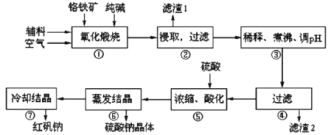
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________。
(2)“③”中调节pH至4.7,目的是________。
(3)“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式:________。
,请写出该平衡转化的离子方程式:________。
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶(锥形瓶)中,加入10mL2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定(I2+2![]() =2I-+
=2I-+![]() )。
)。
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,所得产品的中Na2Cr2O7的纯度(设整个过程中其它杂质不参与反应)________。