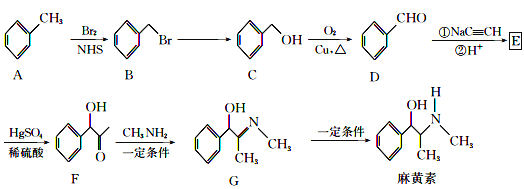
题目内容
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属,还含有少量 CeF4。以下是从精炼铜的阳极泥中回收银、金的流程图:
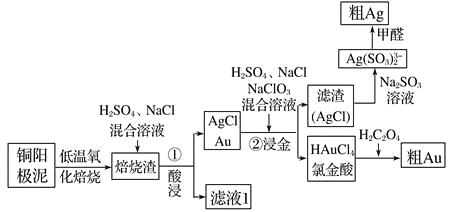
已知:①Ce 常见的化合价为+3、+4 价;②CeF4 很稳定,1000℃ 时仍不分解。
(1)①酸浸步骤中有少量黄绿色气体生成,滤液 1 中含有CeCl3,写出焙烧渣酸浸生成 CeCl3的化学方程式_________________________________________ 。
(2)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是__________
(3)“②浸金”反应中, H2SO4 的作用为_________________________,该步骤的分离操作中, 需要对所得的 AgCl 进行水洗。判断 AgCl 已经洗涤干净的方法是:取最后一次洗涤液,滴________________________试剂,出现_______现象,证明 AgCl 未洗涤干净。
(4)氯金酸(HAuCl4)在 pH 为 2~3 的条件下被草酸还原为 Au,同时放出二氧化碳气体,写出该反应方程式_____________________________________________
(5)甲醛还原法沉积银,(Ag(SO3 )2 3-)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为 _______________
(6)电解法精炼银,用 10A 的电流电解 30min,若电解效率(通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比)为 80%,此时可得到银单质的质量为__________ (保留 1 位小数,法拉第常数 96500C/mol)。
【答案】2CeF4 + 4H2SO4 + 8NaCl = 2CeCl3+ 4Na2SO4 + 8HF + Cl2↑ 高温焙烧时,生成的Ag2O又分解为Ag和O2 提供H+,增强NaClO3的氧化性 Ba(NO3)2溶液 有白色沉淀产生 2HAuCl4+3H2C2O4 = 2Au+8HCl+6CO2↑ 4Ag(SO3)23 + HCHO + 5OH-=4Ag + 8SO32 + 3H2O + HCO3- 16.1g
【解析】
⑴①酸浸步骤中有少量黄绿色气体生成,滤液1中含有CeCl3,说明CeF4与H2SO4、NaCl反应生成CeCl3、Cl2等,根据氧化还原反应书写化学方程式;
⑵高温时,氧化银分解又生成Ag和氧气;
⑶“②浸金”反应中,加硫酸能提供H+,增强NaClO3的氧化性;溶液中含有硫酸根离子,加Ba(NO3)2溶液来检验最后一次洗液中是否含有硫酸根离子;
⑷氯金酸与草酸反应生成Au、HCl和二氧化碳,根据氧化还原反应书写化学方程式;
⑸甲醛还原法沉积银,(Ag(SO3 )23)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,根据氧化还原反应书写离子方程式;
⑹先计算电路中电子物质的量,再计算生成的银质量。
⑴①酸浸步骤中有少量黄绿色气体生成,滤液1中含有CeCl3,说明CeF4与H2SO4、NaCl反应生成CeCl3等,根据氧化还原反应得到化学方程式2CeF4 + 4H2SO4 + 8NaCl = 2CeCl3+ 4Na2SO4 + 8HF + Cl2↑,故答案为:2CeF4 + 4H2SO4 + 8NaCl = 2CeCl3+ 4Na2SO4 + 8HF + Cl2↑;
⑵低温焙烧时,Ag与氧气转化为Ag2O,高温时,氧化银分解又生成Ag和氧气,因此采用“低温焙烧”而不采用“高温焙烧”,故答案为:高温焙烧时,生成的Ag2O又分解为Ag和O2;
⑶“②浸金”反应中,酸性条件下,Au与氯酸钠反应,加硫酸能提供H+,增强NaClO3的氧化性;溶液中含有硫酸根离子,检验最后一次洗液中是否含有硫酸根离子,其操作为取最后一次洗涤液少许于试管中,滴入Ba(NO3)2溶液,若没有白色沉淀产生,则已经洗涤干净,反之,则需要继续洗涤,故答案为:提供H+,增强NaClO3的氧化性;Ba(NO3)2溶液;有白色沉淀产生;
⑷氯金酸与草酸反应生成Au、HCl和二氧化碳,反应的化学方程式为:2HAuCl4+3H2C2O4 = 2Au+8HCl+6CO2↑,故答案为:2HAuCl4+3H2C2O4 = 2Au+8HCl+6CO2↑;
⑸甲醛还原法沉积银,(Ag(SO3 )23)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为4Ag(SO3)23 + HCHO + 5OH-=4Ag + 8SO32 + 3H2O + HCO3-,故答案为:4Ag(SO3)23 + HCHO + 5OH-=4Ag + 8SO32 + 3H2O + HCO3-;
⑹电解法精炼银,用 10A 的电流电解 30min,电路中电子物质的量为![]() ,若电解效率为 80%,生成1mol银转移1mol电子,所以生成的银为0.1865mol×80%×108 gmol1 ≈16.1g,故答案为:16.1g。
,若电解效率为 80%,生成1mol银转移1mol电子,所以生成的银为0.1865mol×80%×108 gmol1 ≈16.1g,故答案为:16.1g。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大