题目内容
20.下列说法正确的是( )| A. | SO2可以使Br2水褪色,是因为SO2具有漂白性 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故Fe与I2反应生成FeI3 | |
| D. | 可以用铝制的容器储存和运输浓硝酸是因为常温下铝遇到浓硝酸钝化 |
分析 A.二氧化硫具有还原性,能被强氧化剂氧化;
B.Na和投入氯化镁溶液中时先和水反应;
C.氯气具有强氧化性,能将铁氧化为高价铁,碘的氧化性较氯气弱,能将铁氧化为低价态;
D.常温下,铝和浓硝酸、浓硫酸发生钝化现象.
解答 解:A.溴具有强氧化性,二氧化硫具有还原性,将二氧化硫通入溴水中,二者发生氧化还原反应生成硫酸和HBr,二氧化硫体现还原性而不是漂白性,故A错误;
B.Na和投入氯化镁溶液中时先和水反应生成NaOH,NaOH和氯化镁发生复分解反应生成氢氧化镁,所以得不到Mg,应该电解熔融氯化镁制取Mg,故B错误;
C.氯气具有强氧化性,能将铁氧化为高价铁,碘的氧化性较氯气弱,能将铁氧化为低价态,所以铁和碘反应生成碘化亚铁,故C错误;
D.常温下,铝和浓硝酸、浓硫酸发生钝化而阻止进一步被氧化,所以常温下,可以用铝制容器储存和运输浓硝酸,故D正确;
故选D.
点评 本题考查元素化合物知识,涉及二氧化硫、钠、氯气、碘及浓硝酸的性质,明确元素化合物性质与用途关系是解本题关键,知道常见金属冶炼方法、钝化现象,注意二氧化硫漂白性和还原性排布,易错选项是C.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
11.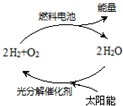 能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
 能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
8.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子序数大于y的原子序数 | |
| B. | x的电负性小于y的电负性 | |
| C. | x的离子半径大于y的离子半径 | |
| D. | x的第一电离能小于y 的第一电离能 |
5.如下性质的递变中,不正确的是( )
| A. | HCl、H2S、PH3的稳定性依次减弱 | |
| B. | HClO4、H2SO4、H3PO4的酸性依次减弱(相同条件下) | |
| C. | CsOH、KOH、LiOH的碱性依次增强 | |
| D. | Na+、Mg2+、Al3+的离子半径逐渐减小 |
9.如表所示,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
 .
.