题目内容
8.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )| A. | x的原子序数大于y的原子序数 | |
| B. | x的电负性小于y的电负性 | |
| C. | x的离子半径大于y的离子半径 | |
| D. | x的第一电离能小于y 的第一电离能 |
分析 x元素的阴离子和y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则y元素处于x元素的下一周期,x为非金属元素,最外层电子数较多,y为金属元素,最外层电子数相对较少.
A.原子所处周期越大,原子序数越大;
B.非金属性越强,电负性越大;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.非金属性越强,第一电离能越高.
解答 解:X元素的阴离子和Y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则Y元素处于X元素的下一周期,X为非金属元素,最外层电子数较多,Y为金属元素,最外层电子数相对较少.
A.y元素处于x元素的下一周期,则x的原子序数小于y的原子序数,故A错误;
B.x为非金属元素,y为金属元素,故x的电负性高于y的电负性,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故x的离子半径大于y的离子半径,故C正确;
D.x为非金属元素,y为金属元素,故x的第一电离能大于y的第一电离能,故D错误;
故选D.
点评 本题考查结构性质位置的关系、微粒半径与电负性、第一电离能比较等,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.

练习册系列答案
相关题目
18.关于硝酸的说法正确的是( )
| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
19.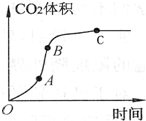 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
的变化),实验结果如图所示,下列说法错误的是( )
 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )
| A. | AB段反应速率最快的原因可能是反应放热,体系温度升高 | |
| B. | BC段反应速率变慢的原因可能是盐酸浓度降低 | |
| C. | 该反应速率也可以用CaCl2的浓度变化与时间关系来表示 | |
| D. | C点后CO2体积不变的原因一定是盐酸消耗完 |
3.某有机物在O2中充分燃烧生成CO2和H2O的物质的量之比为1:1,由此可得出的结论是( )
| A. | 该有机物分子中C、H、O原子个数比为1:2:3 | |
| B. | 该有机物中必定含有氧元素 | |
| C. | 该有机物分子中C、H原子个数比为1:2 | |
| D. | 该有机物化学式为C2H4 |
13.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素 |
20.下列说法正确的是( )
| A. | SO2可以使Br2水褪色,是因为SO2具有漂白性 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故Fe与I2反应生成FeI3 | |
| D. | 可以用铝制的容器储存和运输浓硝酸是因为常温下铝遇到浓硝酸钝化 |
18.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
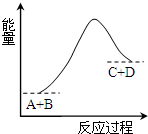

| A. | 该反应反应物A的能量大于生成物D的能量 | |
| B. | 该反应为吸热反应 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |