题目内容
9.如表所示,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.C2H4与酸性高锰酸钾反应生成二氧化碳气体;
B.加入NaOH溶液生成NaCl,混入新杂质;
C.甲酸可与碳酸钠反应;
D.加入溴水生成三溴苯酚,三溴苯酚与苯混溶.
解答 解:A.C2H4与酸性高锰酸钾反应生成二氧化碳气体,引入新杂质,应用溴水除杂,故A错误;
B.加入NaOH溶液生成NaCl,混入新杂质,应用氨水除杂,故B错误;
C.甲酸可与碳酸钠反应生成甲酸钠,蒸馏可得到甲醛,故C正确;
D.加入溴水生成三溴苯酚,三溴苯酚与苯混溶,不能得到纯净的苯,应加入NaOH溶液,然后分液,故D错误.
故选C.
点评 本题考查化学实验方案的评价,题目侧重于物质的分离、提纯的实验方案的评价,注意物质的性质的异同,除杂时不能影响被提纯的物质,且不能引入新的杂质.

练习册系列答案
相关题目
19.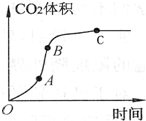 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
的变化),实验结果如图所示,下列说法错误的是( )
 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )
| A. | AB段反应速率最快的原因可能是反应放热,体系温度升高 | |
| B. | BC段反应速率变慢的原因可能是盐酸浓度降低 | |
| C. | 该反应速率也可以用CaCl2的浓度变化与时间关系来表示 | |
| D. | C点后CO2体积不变的原因一定是盐酸消耗完 |
20.下列说法正确的是( )
| A. | SO2可以使Br2水褪色,是因为SO2具有漂白性 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故Fe与I2反应生成FeI3 | |
| D. | 可以用铝制的容器储存和运输浓硝酸是因为常温下铝遇到浓硝酸钝化 |
4.在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A. | 元素R位于周期表中第ⅤA族 | |
| B. | R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
14.在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
| A. | 制催化剂的材料 | B. | 半导体材料 | ||
| C. | 制农药的材料 | D. | 耐高温、耐腐蚀的合金材料 |
18.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
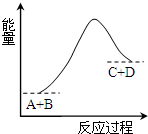

| A. | 该反应反应物A的能量大于生成物D的能量 | |
| B. | 该反应为吸热反应 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
12.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
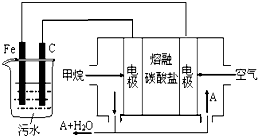

| A. | Fe为阳极,其电极反应为:Fe-3e-+3OH-=Fe(OH)3↓ | |
| B. | 通入甲烷的电极为负极,其电极反应为:CH4-8e-+10OH-=CO32-+7H2O | |
| C. | 为了使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2 | |
| D. | 实验过程中,若在阴极产生了4.48 L气体,则电路中通过的电子个数为0.4NA |
