题目内容
12.实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.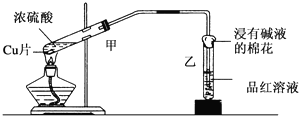
(1)写出甲装置中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O
(2)反应后品红溶液褪色,盛放品红溶液的试管口放一团浸有碱液的棉花,作用是吸收SO2,防止污染空气,反应的化学方程式2NaOH+SO2=Na2SO3+H2O.
分析 (1)甲装置中铜与浓硫酸加热反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫有毒,多余的二氧化硫需要用碱液吸收;二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水.
解答 解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O;
(2)由于二氧化硫具有漂白性,则反应后品红溶液会褪色;二氧化硫是一种有毒气体,则盛放品红溶液的试管口放一团浸有碱液的棉花的作用是吸收SO2,防止污染空气,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,
故答案为:褪色;吸收SO2,防止污染空气;2NaOH+SO2=Na2SO3+H2O.
点评 本题考查了浓硫酸的性质、二氧化硫的性质及检验,题目难度中等,注意掌握浓硫酸的性质,明确二氧化硫的性质及检验方法,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
2.有下列几种说法:①含同元素的微粒的化学性质不一定相同;②相对分子质量相同的物质如果结构不同则互为同分异构体;③同分异构体的化学性质一定相同;④同系物具有相同的通式;⑤同系物的化学性质相似;⑥互为同系物的物质间不可能互为同分异构体;⑦两相邻同系物的相对分子质量相差14;⑧化学式相同,各元素质量分数也相同的物质一定是同种物质;以上说法中不正确的是( )
| A. | ②③④ | B. | ②③⑧ | C. | ③④⑤⑦⑧ | D. | ②⑥⑦⑧ |
3.某有机物在O2中充分燃烧生成CO2和H2O的物质的量之比为1:1,由此可得出的结论是( )
| A. | 该有机物分子中C、H、O原子个数比为1:2:3 | |
| B. | 该有机物中必定含有氧元素 | |
| C. | 该有机物分子中C、H原子个数比为1:2 | |
| D. | 该有机物化学式为C2H4 |
20.下列说法正确的是( )
| A. | SO2可以使Br2水褪色,是因为SO2具有漂白性 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故Fe与I2反应生成FeI3 | |
| D. | 可以用铝制的容器储存和运输浓硝酸是因为常温下铝遇到浓硝酸钝化 |
7.下列只含极性键的共价化合物为( )
| A. | KCl | B. | Na2O2 | C. | H2O2 | D. | CH4 |
4.在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A. | 元素R位于周期表中第ⅤA族 | |
| B. | R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
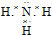 ,B的晶体类型是分子晶体.
,B的晶体类型是分子晶体.