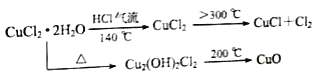
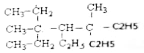题目内容
【题目】短周期元素X、Y、Z、W、N的原子序数依次增大,其中X的一种同位素原子没有中子,Y的一种核素可做考古学家测文物的年代,Z为地壳中含量最多的非金属元素,相同质量的W的单质在空气中缓慢氧化的产物与其在空气中燃烧产物不同,但转移的电子数相同,N原子为所在周期中原子半径最小的原子(稀有气体除外)。
(1)写出X元素没有中子的原子符号___________;Y与X形成的X元素的质量分数最高的分子的结构式___________;X、Z、N形成的原子个数比1:1:1的分子的电子式___________。
(2)用电子式表示W2Z形成过程___________;
(3)Z、W、N的简单离子半径从大到小的顺序___________(用离子符号表示);
(4)甲由上述元素X、Y元素形成的18电子分子,常温下是气态,可燃烧。
①甲分子中若两个H原子被Br取代,则可生成___________种溴代物;
②若把甲与氧气设计成燃烧电池(KOH溶液为电解质溶液),则负极反应的方程式为___________;放电一段时间后溶液的碱性___________(增强、减弱、不变)。
【答案】(1)11H![]()
![]() (2)
(2)![]()
(3)Cl->O2->Na+(4)2 CH3CH3-14e-+18OH-=2CO32-+12H2O 减弱
【解析】试题分析:X的一种同位素原子没有中子,可知X为氢元素;Y的一种核素可做考古学家测文物的年代,可知Y为碳元素;Z为地壳中含量最多的非金属元素,可知Z为氧元素;相同质量的W的单质在空气中缓慢氧化的产物与其在空气中燃烧产物不同,但转移的电子数相同,可知W为钠元素;N原子为所在周期中原子半径最小的原子,可知N为氯元素;
(1)氢元素原子核内质子数为1,没有中子的原子符号为11H;C与H形成的氢元素的质量分数最高的物质是甲烷,其分子的结构式为![]() ;H、O、Cl形成的原子个数比1:1:1的分子为HClO,其的电子式为
;H、O、Cl形成的原子个数比1:1:1的分子为HClO,其的电子式为![]() 。
。
(2)Na2O的电子式形成过程为![]() ;
;
(3)根据离子结构相同时核电荷数越大离子半径越小,离子核外电子层数越多离子半径越大,可知O2-、Na+、Cl-的简单离子半径从大到小的顺序是Cl->O2->Na+;
(4)甲由上述元素H、C元素形成的18电子分子,常温下是气态,可燃烧,则甲为乙烷
①乙烷分子中若两个H原子被Br取代,则可生成1,2-二溴乙烷或1,1-二溴乙烷共2种溴代物;
②乙烷与氧气设计成燃烧电池(KOH溶液为电解质溶液),则负极上乙烷发生氧化反应的电极方程式为CH3CH3-14e-+18OH-=2CO32-+12H2O;放电过程中因消耗OH-,一段时间后溶液的碱性减弱。