题目内容
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。
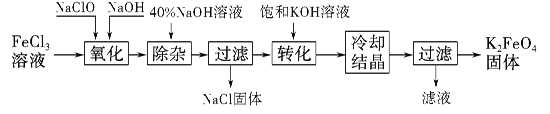
(1)已知“氧化”过程中氧化产物为Na2FeO4,写出其反应的化学方程式:
(2)“转化”过程中发生反应的化学方程式为 。
(3)上述工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为 法。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
【答案】(1)FeCl3+2NaOH+10NaClO = 2Na2FeO4+9NaCl+5H2O
(2)Na2FeO4+2KOH===K2FeO4+2NaOH
(3)重结晶
(4)Fe+8OH--6e-===FeO42-+4H2O
【解析】
试题分析:(1)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O。
故答案为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
(2)“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH。
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH。
(3)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤。这种分离提纯的方法为重结晶。
故答案为:重结晶 ;
(4)由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,阳极电极反应式为Fe+8OH--6e-=FeO42-+4H2O。故答案为:Fe+8OH--6e-=FeO42-+4H2O。

 名校课堂系列答案
名校课堂系列答案【题目】(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______________;
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______________(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______________H3PO4; HClO4______________HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______________;
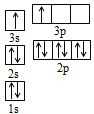
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______________。