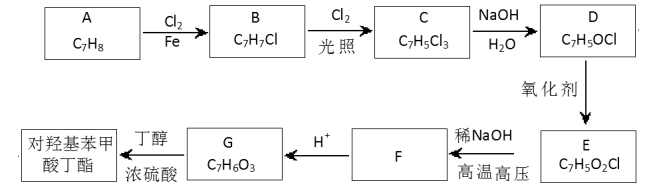
题目内容
【题目】(1)有两种气体单质Am和Bn。已知7.2g Am和6.3 g Bn所含的原子个数相同,分子个数之比却为2∶3。又知A原子中L电子层含电子数是K电子层的3倍。通过计算回答:写出B的元素名称______
(2) 向含0.1molFeBr2的溶液中通入0.1molCl2充分反应,反应的离子方程式为___________________(写成一个离子方程式)
(3)将192克铜投入1L浓度均为2mol/L硝酸、硫酸的混合酸,充分反应生成NO______L(标准状态下)(还原产物只有NO)
(4)取100克铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解,已知硝酸的还原产物为NO,且NO体积在标准状态下为67.2L;向所得的溶液中加入适量的2mol/L氢氧化钠溶液,则能得到沉淀最大值为______克
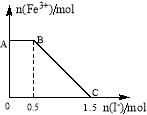
(5)将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+ 的物质的量随加入的KI的物质的量的变化关系如图所示,开始加入的KMnO4的物质的量为____________(附注:高锰酸钾将16H+ + 2MnO4- +10I- =5I2 +2Mn2+ +8H2O)
【答案】
(1)氮;
(2)2Fe2++ 2Br-+2Cl2=2Fe3++Br2+4Cl-
(3)33.6L;(4)253g;(5)0.3mol
【解析】
试题分析:(1)根据A原子的L层电子数是K层的3倍,可推知A是氧元素,Am中含A原子的物质的量为![]() =0.45 mol,则Bn中含B原子数也为0.45 mol,B元素的原子的摩尔质量=
=0.45 mol,则Bn中含B原子数也为0.45 mol,B元素的原子的摩尔质量=![]() =14 g/mol,故B元素为氮元素,故答案为:氮;
=14 g/mol,故B元素为氮元素,故答案为:氮;
(2) 1molFeBr2的溶液中通入1molCl2,先与亚铁离子反应,再与溴离子反应,其反应的离子方程式为:2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;故答案为:2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;
(3)n(Cu)=![]() =3mol,n(HNO3)=n(H2SO4)=2mol/L×1L=2mol,离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,该溶液中n(H+)=n(HNO3)+2n(H2SO4)=6mol,根据方程式知,如果3molCu完全溶解需要n(H+)为8mol>6mol,所以有部分Cu溶解,如果氢离子完全反应需要n(NO3-)=
=3mol,n(HNO3)=n(H2SO4)=2mol/L×1L=2mol,离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,该溶液中n(H+)=n(HNO3)+2n(H2SO4)=6mol,根据方程式知,如果3molCu完全溶解需要n(H+)为8mol>6mol,所以有部分Cu溶解,如果氢离子完全反应需要n(NO3-)=![]() ×2=1.5mol<2mol,因此氢离子完全反应,生成NO的物质的量==
×2=1.5mol<2mol,因此氢离子完全反应,生成NO的物质的量==![]() ×2=1.5mol,标准状况下的体积为1.5mol×22.4L/mol=3.36L,故答案为:33.6L;
×2=1.5mol,标准状况下的体积为1.5mol×22.4L/mol=3.36L,故答案为:33.6L;
(4)标准状态下,67.2LNO的物质的量为![]() =3mol,转移电子的物质的量=3mol×(5-2)=9mol,铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解后生成的金属阳离子,与氢氧化钠反应生成沉淀时结合的氢氧根离子的物质的量与转移的电子的物质的量相等,因此得到沉淀最大值=100g+9mo×17g/mol=253g,故答案为:253g;
=3mol,转移电子的物质的量=3mol×(5-2)=9mol,铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解后生成的金属阳离子,与氢氧化钠反应生成沉淀时结合的氢氧根离子的物质的量与转移的电子的物质的量相等,因此得到沉淀最大值=100g+9mo×17g/mol=253g,故答案为:253g;
(5)酸化的KMnO4溶液与FeSO4溶液混合后发生氧化还原反应,可知氧化性KMnO4>Fe3+;由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为高锰酸钾和碘化钾的反应,BC段为铁离子和碘化钾的反应。根据电子守恒有MnO4-~~5I-,故剩余的KMnO4的物质的量为0.1mol,根据电子守恒有MnO4-~~5Fe2+~~5Fe3+~~5I-,故与Fe2+反应的KMnO4的物质的量为0.2mol,故原来KMnO4的物质的量为0.3mol,故答案为:0.3mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案