题目内容
【题目】NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备:
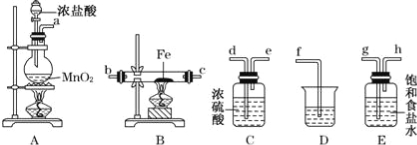
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2∶1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。

(1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色浑浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为________________;
实验Ⅱ.产品纯度的检测:
(3)已知:Na2S2O3·5H2O的摩尔质量为248 g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010 mol/L碘水滴定到终点时,消耗碘水溶液v mL。①滴定终点的现象是 ;②该样品纯度是______________________;
(4)滴定过程中可能造成实验结果偏低的是___________________;
A.锥形瓶未用Na2S2O3溶液润洗
B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数
C.滴定终点时仰视读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
实验Ⅲ.有毒废水的处理:
(5)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10 mL 0.1 mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________。
【答案】
(1)C;
(2)Na2S2O3+ SO2+H2O=2 NaHSO3+S↓;
(3)①最后滴入一滴碘水,溶液颜色变成蓝色,且半分钟内部变色;②![]() %;
%;
(4)BD;
(5)CN-+S2O32-=SCN-+SO32-。
【解析】
试题分析:(1)二氧化硫易溶于水,所以不能用稀酸,浓硫酸中氢离子浓度很小,不利于与亚硫酸钠固体反应,所以制备二氧化硫用中等浓度的硫酸;故答案为:C;
(2)Na2S2O3中S的化合价为+2价,pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色浑浊。是Na2S2O3发生了歧化反应,生成了亚硫酸钠和硫沉淀,通入SO2过量,与生成的亚硫酸钠反应生成亚硫酸氢钠,反应的化学反应方程式为Na2S2O3+ SO2+H2O=2 NaHSO3+S↓,故答案为:Na2S2O3+ SO2+H2O=2 NaHSO3+S↓;
(3)①滴定终点时,溶液颜色变成蓝色,且半分钟内部变色,故答案为:最后滴入一滴碘水,溶液颜色变成蓝色,且半分钟内部变色;
②vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,则:
2Na2 S2O3~~~~~~~I2
2 1
n(Na2 S2O3) v×10-5mol
所以n(Na2 S2O3)=2×v×10-5mol=2v×10-5mol,Na2 S2O35H2O晶体的质量为2v×10-5mol×248g/mol=496v×10-5g,则该样品纯度为![]() ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %;
%;
(4)A.滴定实验中,锥形瓶不能用Na2S2O3溶液润洗,因此对实验结果无影响,不选;B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数,导致碘水的体积偏小,实验结果偏低,正确;C.滴定终点时仰视读数,使得实验终点读数偏大,溶液体积偏大,实验结果偏大,不选;D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,导致实验终点读数偏小,溶液体积偏小,实验结果偏低,正确;故选BD;
(5)根据实验现象,说明反应生成了SCN-,2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,溶质的物质的量之比1:1,结合质量守恒和电荷守恒可知,Na2S2O3解毒的离子反应方程式为CN-+S2O32-=SCN-+SO32-,故答案为:CN-+S2O32-=SCN-+SO32-。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______________;
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______________(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______________H3PO4; HClO4______________HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______________;
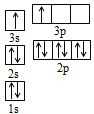
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______________。